本文是一篇医学论文,笔者认为未来的研究可以进一步探究AC591颗粒以及18β-GA在人体中的药代动力学和毒理学特性,以及与其它保护剂的联用效果等方面,以期更好地开发和利用该保护剂来预防和治疗顺铂诱导的听力下降。
第一章引言
1.1顺铂临床应用及其耳毒性方面的研究进展
1.1.1顺铂在癌症治疗中的作用机制和副作用
顺铂(Cisplatin)作为一种重要的铂类化疗药,已被广泛应用于多种癌症的治疗,包括卵巢癌、泌尿系统肿瘤、肺癌等+。其治疗原理主要基于对DNA结构的影响:顺铂能够与DNA中的嘌呤碱基共价结合,形成DNA损伤点,进而阻止DNA链的延伸[1]。这一机制干扰了肿瘤细胞的DNA复制和转录过程,触发细胞凋亡,直接导致肿瘤细胞死亡。除此之外,顺铂还能影响细胞内其他成分,如与蛋白质相互作用,影响细胞代谢和功能,并可能诱发肿瘤细胞的DNA修复机制失常,从而强化其抗肿瘤效果[2-4]。
尽管顺铂在抑制肿瘤生长和扩散方面效果显著,但其伴随的广泛副作用也引起了广泛关注。其中,顺铂对肾脏的毒性尤为突出,主要体现在肾小管损伤上。顺铂在近端肾小管细胞的线粒体中积聚,导致过量产生的活性氧(ROS)降低膜电位,破坏线粒体氧化还原平衡[5]。同时,顺铂抑制小管自噬功能,进一步强化线粒体损伤,引发近端肾小管破坏和功能障碍,导致肾功能不全[5]。研究还表明顺铂的肾毒性与铁死亡机制有关[6]。顺铂引发的肾毒性涉及多重机制,包括氧化应激、细胞凋亡、炎症和自噬等[7,8],了解这些潜在机制对研究肾毒性干预策略至关重要。
顺铂也有严重的神经系统毒性[9]。该药物引发的周围神经炎症状多样,常见表现包括手套和袜套型感觉障碍、肌肉无力及萎缩、腱反射减退和血管运动障碍[10]。这些症状可能孤立出现或以多种组合形态共存,严重影响神经传导及感知功能,并导致不同部位功能的障碍[11]。由于顺铂诱导的周围神经炎的严重程度与在背根神经节(DRG)中检测到的顺铂量相关,所以背根神经节被认为是顺铂的主要攻击对象[12]。目前关于顺铂神经毒性的确切病理生理学尚不清楚,因此现在还没有发现较为有效的治疗顺铂神经毒性的手段。
1.2 p53信号通路在顺铂耳毒性中的调节作用
1.2.1 p53信号通路的基本特征
p53信号通路的基本特征是生物学和医学领域中一个备受关注的课题。p53基因最早是在1979年由David Lane等科学家发现的[45]。通过对该片段的进一步研究,科学家发现p53基因在多种肿瘤中都会发生突变或缺失,这表明p53可能是一种抑制肿瘤发生的基因[46]。此后,p53被确认为一种肿瘤抑制基因,事实上,它也是细胞染色DNA的正常组成成分,具有重要的生理功能[47]。p53基因是细胞生物学中最重要的基因之一,其主要作用包括:1.维持基因组稳定性:p53在细胞受到DNA损伤或其他压力时,可以促进DNA修复,防止DNA损伤的传递到子代细胞中,从而维护基因组的稳定性[48]。2.促进细胞凋亡:p53可以启动细胞凋亡途径,通过调控凋亡相关基因的表达,促进异常或受损细胞的凋亡,从而防止异常细胞的过度增殖和转化为肿瘤细胞[49,50]。3.调控细胞周期:p53在细胞周期调控中起重要作用,当细胞受到压力或DNA损伤时,p53会促使细胞周期停滞,以便维修受损的DNA,避免异常细胞复制[51,52]。4.抑制血管生成:p53还能抑制肿瘤相关的血管生成过程,从而限制肿瘤的生长和扩散[53]。p53作为肿瘤抑制基因,其激活、失活与肿瘤的关系非常密切[54]。当细胞受到DNA损伤、细胞应激或其他异常情况时,p53信号通路会被激活,进而导致p53蛋白的稳定性增加,转录活性增强,促使细胞进行DNA修复、细胞周期停滞和凋亡等抗肿瘤反应[55]。这种激活状态有助于维持基因组的稳定性,排除异常细胞,从而抑制肿瘤的发生和发展[56]。相反,p53的突变、缺失或失活状态会导致p53信号通路的失活[57]。失活的p53无法有效地促进异常细胞的凋亡或停滞,使得这些异常细胞得以无限制地生长和扩散,最终形成肿瘤[58]。
第二章材料与方法
2.1实验动物的选择
动物模型的选择对于研究结果的准确性和可靠性至关重要。在本研究中,我们选择了小鼠作为实验动物。小鼠作为一种常用的实验动物模型,具有许多优点,如其生命周期短、繁殖能力强、易于饲养、遗传背景明确等。
首先,我们选择了C57BL/6小鼠作为实验动物,所有小鼠均购自江苏集萃药康生物科技股份有限公司(Gempharmatech Co.,Ltd.)。所有小鼠均可自由获取食物和水,并于标准鼠笼中饲养,每天接受12小时光照和12小时无光照的黑暗条件饲养。所有动物研究均遵循东南大学机构动物护理和使用委员会的程序。C57BL/6小鼠是一种常用的实验小鼠品系,其基因背景相对稳定,具有较高的遗传稳定性。此外,C57BL/6小鼠的听觉系统与人类的相似度较高,因此选择它作为顺铂诱导的听力下降模型的研究动物具有较好的生理学意义。
在实验开始前,所有动物将进行3天的适应性饲养,并进行初步的听力测试,以排除已经存在听力问题的个体。
2.2设计给药方案
AC591颗粒作为一种潜在的听力保护剂,其给药方案的设计至关重要。在本研究中,我们对AC591颗粒的给药方案进行了详细设计,以评估其对顺铂诱导的听力下降的保护效果。
首先,我们选择了小鼠作为研究对象,在其身上建立了顺铂诱导的听力下降的动物模型。根据前期实验结果,我们确定了适宜的顺铂剂量和给药方式。我们按小鼠体重计算小鼠腹腔注射所需的顺铂剂量,每只小鼠每天需要注射的顺铂总量为4 mg/kg,连续七天注射,则总共注射的顺铂总量为28 mg/kg。然后,我们根据顺铂的给药时间及其剂量,结合AC591颗粒的特性,制定了AC591颗粒的给药方案。低剂量AC591浓度为0.234 g/ml,中剂量AC591浓度为0.468 g/ml,高剂量AC591浓度为0.936 g/ml。每天按每10 g体重灌胃0.1 ml AC591的方法进行灌胃,连续灌胃3周不会对小鼠产生毒性作用。
在实验中,我们采用了随机分组方法,将小鼠分为5组:对照组、顺铂组、以及3个不同浓度的AC591组。治疗周期为3周,低剂量AC591组灌胃的AC591浓度为0.234g/ml,中剂量AC591组AC591浓度为0.468 g/ml,高剂量AC591组AC591浓度为0.936g/ml。每天按每10 g体重灌胃0.1 ml AC591的方法进行灌胃,并在最后7天每天腹腔注射4 mg/kg顺铂。顺铂组接受生理盐水灌胃,最后1周腹腔注射顺铂。对照组接受生理盐水灌胃,最后1周腹腔注射生理盐水。每次顺铂(齐鲁,FA2A1024B)腹腔注射的剂量为4mg/kg小鼠体重。实验完成后进行ABR听力测试和数据分析,评估AC591颗粒对听力的保护作用,并探讨其保护机制。
第三章 结果与讨论 .......................... 13
3.1 AC591 颗粒对顺铂诱导的小鼠听力下降的保护效果 ................ 13
3.2 AC591 减轻顺铂诱导的耳蜗神经纤维损伤和带状突触缺失 .... 15
3.3 AC591 通过调控顺铂激活的p53 信号通路保护听力 ............... 17
3.4 AC591 抑制顺铂诱导的耳蜗内的铁死亡 ................... 19
主要结论与展望 ............................. 27
主要结论 .................................... 27
展望 ............................. 28
第三章结果与讨论
3.1 AC591颗粒对顺铂诱导的小鼠听力下降的保护效果
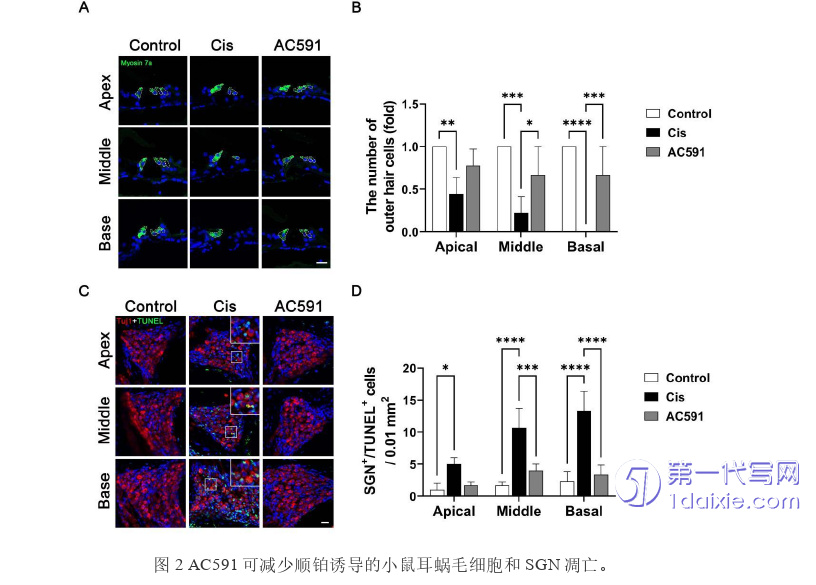
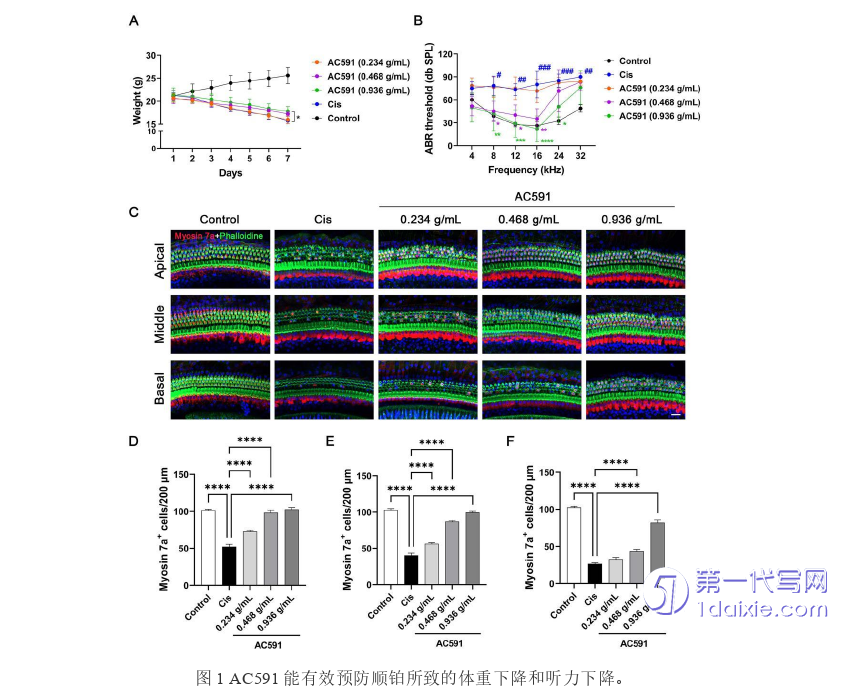
为了研究AC591对小鼠听力损失的保护作用,我们先建立了顺铂诱导耳毒性的小鼠模型。有文献报道通过给C57BL/6小鼠腹腔注射顺铂(30mg/kg,1mg/ml)可以构建顺铂耳毒性模型[108]。我们发现按30mg/kg剂量一次性给小鼠注射会导致小鼠大批量的死亡,每天给小鼠腹腔注射4 mg/kg顺铂,连续7天不会诱导小鼠的大量死亡,而且可以成功诱导小鼠耳聋,并且解剖小鼠的耳蜗组织后发现小鼠毛细胞会显著缺失。当我们成功建立小鼠模型后,随后确定了AC591的给以方案。采用随机分组方法,将小鼠分为5组:对照组、顺铂组、以及3个不同浓度的AC591组。治疗周期为3周,低剂量AC591组灌胃的AC591浓度为0.234 g/ml,中剂量AC591组AC591浓度为0.468 g/ml,高剂量AC591组AC591浓度为0.936 g/ml。按0.1 ml/10 g的剂量每天给小鼠进行AC591灌胃,并在最后7天AC591灌胃的同时每天腹腔注射4 mg/kg顺铂。小鼠腹腔注射顺铂后体重明显减轻,而AC591(0.936 g/mL)的预处理可以减轻顺铂诱导的小鼠体重下降(图1A)。ABR测听结果显示,0.468 g/mL和0.936 g/mL剂量的AC591会导致顺铂诱导的8、12、16和24kHz的听力阈值升高不明显(图1B)。此外,耳蜗切片的免疫染色显示,给予0.468g/mL和0.936 g/mL剂量AC591灌胃的小鼠,顺铂诱导的耳蜗顶、中、底转的毛细胞的损失显著减轻(图1C-F)。耳蜗组织冰冻切片后的免疫荧光结果也与以上结果吻合(图2A-B)。耳蜗螺旋神经节神经元(spiral ganglion neurons,SGN)的TUNEL染色显示,顺铂治疗导致SGN凋亡增加,而AC591的使用减轻了顺铂诱导的SGN凋亡(图2C-D),这些结果表明AC591可以预防顺铂诱导的听力损失。AC591颗粒作为一种潜在的治疗药物,在顺铂诱导的听力下降中显示出了显著的保护效果。
主要结论与展望
主要结论
在本研究中,我们探索了AC591颗粒作为保护用药对顺铂诱导的听力下降的有效性及其作用机制。AC591是HGWD的标准化提取物。通过我们的研究,我们确认了AC591颗粒对听力下降具有显著的保护效果。我们的研究结果表明AC591可以减轻顺铂引起的小鼠听力阈值升高和耳蜗毛细胞、神经纤维和带状突触的损失。RNA-seq和免疫染色分析表明,AC591主要通过抑制p53介导的铁死亡来保护顺铂诱导的听力损失。AC591的使用抑制了顺铂诱导的p53信号通路的上调,提示p53可能是AC591的靶蛋白,该信号通路在AC591保护听力的作用机制中发挥了关键作用。接下来我们评估了AC591对顺铂诱导的耳蜗毛细胞内铁死亡的影响。C11 BODIPY和FerroOrange染色结果显示,顺铂可诱导耳蜗毛细胞内脂质过氧化水平升高和亚铁离子积累,AC591可逆转这一结果。4-HNE和3-NT是脂质过氧化和氧化应激的生物标志物,4-HNE和3-NT的表达升高也是铁死亡发生的标志[121,122]。我们观察到AC591可以抑制顺铂诱导的毛细胞中4-HNE和3-NT的过表达,提示AC591可以调节顺铂诱导的铁死亡。考虑到AC591的复杂成分,我们接下来开始鉴定小鼠用药处理后血清和耳蜗中对听觉功能发挥主要保护作用的活性化合物。利用LC-HRMS分析,我们在血清中鉴定出13种AC591化合物,在耳蜗中鉴定出3种AC591化合物。在这些化合物中,18β-GA在血清和耳蜗中均存在,提示18β-GA可能是AC591预防顺铂性听力损失的关键成分。18β-GA是甘草根提取物的主要活性成分,甘草是具有数千年历史的中草药之一[133]。据报道,18β-GA具有多种药理活性,包括抗炎、抗氧化、抗菌和神经保护作用,并已被用于治疗皮肤病、类风湿性关节炎、肝损伤[130,134-138]。接下来我们进行了分子对接分析,发现18β-GA可以结合到p53蛋白活性袋的表面。18β-GA可能是通过与p53结合从而发挥抑制铁死亡发生的作用。我们发现,AC591颗粒通过抑制p53信号通路的激活,从而阻止铁死亡发生达到了减轻顺铂对听力系统的损伤的目的。并且我们发现了18β-GA是AC591能够起效的主要成分。这些成果在解析听力保护的机制方面做出了一定的贡献,并为开发新的听力保护治疗方法提供理论和实验依据。
参考文献(略)
