本文是一篇医学论文,本研究发现肿瘤细胞分泌的CCL20可能与淋巴细胞表面分子CCR6相结合,将Treg细胞招募到TME中抑制T细胞的杀伤功能并促进T细胞的耗竭。
第一部分 口腔鳞状细胞癌患者肿瘤组织中CCL20、CCR6和Foxp3 表达
1 研究内容与方法
1.1 研究对象
1.1.1 临床OSCC患者纳入和排除
收集2021年~2023年间就诊于新疆医科大学第一附属医院颌面肿瘤外科44例OSCC患者(表1-1)。(1)纳入标准:所有患者均已病理确诊为口腔鳞癌;入院前未接受放化疗治疗;自愿在知情同意书上签字。(2)排除标准:与其他部位肿瘤同时存在;有严重的全身性系统病史。该课题已获得新疆医科大学第一附属医院医学伦理委员会审批(伦理编号:20220308-178)。
1.1.2 临床OSCC患者组织标本的收集
OSCC患者组织标本均由医院病理科调取,组织标本含有癌和癌旁组织。
1.1.3 临床OSCC患者和健康志愿者外周血标本
本研究中20例OSCC患者外周血标本均选自新疆医科大学第一附属医院颌面外科,OSCC纳排标准同1.1.1(表1-2),20例健康志愿者(其中,男性10例、女性10例;年龄<60岁12例、年龄≥60岁8例)外周血标本选自健康体检者。所有临床样本均已通过伦理委员会批准(伦理编号:20220308-178)。
1.3 实验方法
1.3.1 OSCC肿瘤组织石蜡切片
(1)切片前处理:将包埋好的蜡块-20℃冰箱预冷2 h以上。 (2)切片:先调整好切片机,然后将蜡块从-20℃冰箱中快速拿出,防止蜡块软化,切片厚度为4 μm。 (3)烤片:将切好的切片放入60℃的恒温箱中,烘烤时间6 h以上。
1.3.2 石蜡切片HE染色
(1)烤片:将切好的石蜡切片放入60°C的恒温箱中烘烤90 min。 (2)脱蜡水化:首先是二甲苯I 15 min,接着是二甲苯II 15 min,然后是无水乙醇I 2 min,接着是无水乙醇II 2 min,之后是95%酒精2 min,最后是75%酒精2 min,最后用自来水冲洗三遍。(3))使用苏木素溶液对细胞核进行染色:染色时间为2 min,并用自来水冲洗三遍。 (4)分化:使用1%的盐酸乙醇进行1-2 s的分化,然后用自来水冲洗返蓝三次。 (5)伊红染细胞质需要染色3 min,并用自来水冲洗三遍。 (6)脱水过程包括:首先使用75%的酒精处理5 s,接着用80%的酒精再处理5 s,然后是95%的酒精也是5 s。随后,用无水乙醇Ⅱ和无水乙醇Ⅰ各自处理5 s,接着用二甲苯Ⅱ和Ⅰ各处理5 min,之后将其晾干。 (7)封片:使用中性树脂材料进行封片操作,注意防止气泡的形成。
2 结果
2.1 OSCC患者癌组织TME中免疫细胞表达情况
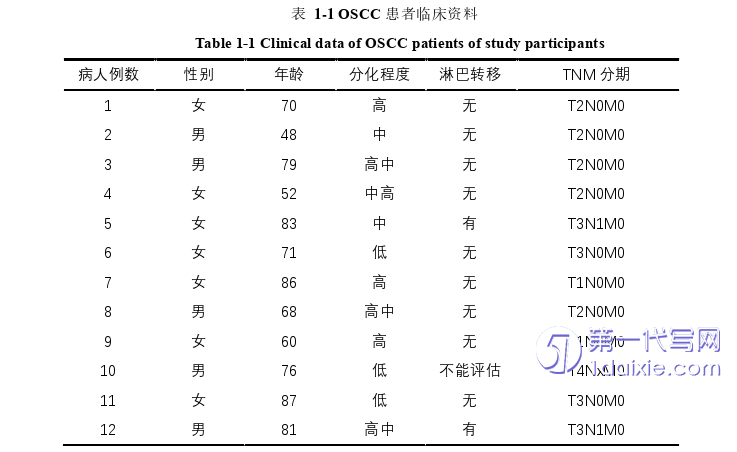
大量的免疫细胞被募集到炎症微环境中,免疫组化结果显示,IHC检测OSCC患者癌组织的免疫微环境中相关免疫细胞的募集情况和α-平滑肌动蛋白的表达变化,持续的感染导致肿瘤间质内形成以CD4+T细胞为主导的炎性细胞带,并伴有CD8+T细胞、CD19 B细胞和CD68巨噬细胞,这些细胞共同形成了OSCC患者癌组织内的炎症微环境,结果如图1-1所示。
2.2 OSCC患者T淋巴细胞的比例变化
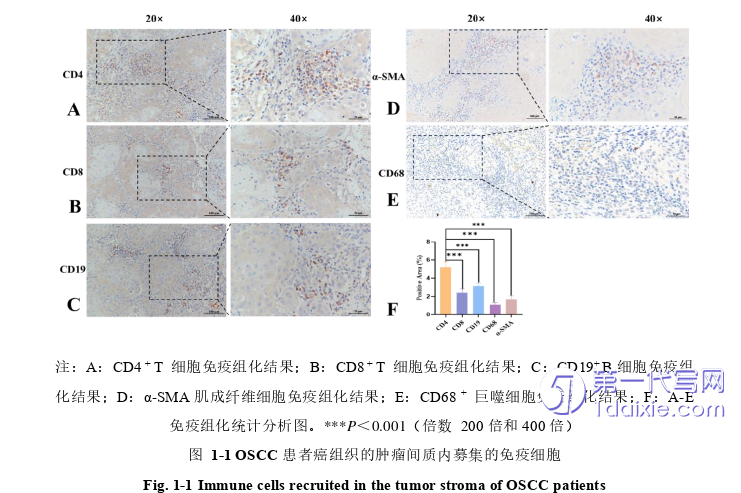
FCM检测OSCC患者和健康对照组的外周血中T淋巴细胞的分布,(1)OSCC患者外周血 CD4+ T 细胞比例显著高于健康对照组(P<0.01),且总 CD4+ T 细胞的数量显著高于对照组(P<0.05)。该结果表明OSCC 患者外周血CD4+ T 细胞占优势。(2)与健康对照组相比,OSCC患者的外周血中CD8+T细胞的比例并没有显著的统计学差异(P>0.05)。结果如图1-2所示。
讨论··················43
小结···················47
讨论
1. P.gingivalis促进OSCC的发展
口腔中存在着复杂的细菌生态平衡系统,吸烟、心理压力、不良饮食习惯和慢性牙周炎可以改变这种平衡。口腔微生态失调,细菌有能力通过释放其毒素和代谢产物、激发局部和全身的炎症反应,以及调整宿主的免疫反应来加速OSCC的进展。在癌变过程中,细菌群落的组成发生了质和量的变化[31]。微生物群具有重要的局部作用,如屏障强化和粘膜免疫的建立,但它也发挥全身作用,包括调节代谢、炎症和免疫。在上皮屏障表面,微生物群的组成和特定物种的丰度影响炎症和免疫力,以及上皮和基质细胞的稳态[32]。西湖大学蔡尚团队在小鼠PyMT 肿瘤样本和人类乳腺癌患者中,成功检测到微生物群的存在, 细胞内细菌可以在肿瘤进展过程中直接调节宿主细胞的活力,这表明肿瘤内微生物群更有可能是肿瘤组织的内在和不可分割的组成部分,而不是于病原体感染而偶然出现[33]。头颈部癌症占所有肿瘤的5%,其中一半发生在口腔。OSCC是头颈部鳞状细胞癌的一个子集,占所有口腔癌的90%以上[34]。尽管手术技术、辅助放疗和化疗取得了进展,但OSCC的发病率似乎在全球范围内增加,5年总生存率仍然很低,约为50- 60%。吸烟、饮酒和嚼槟榔是口癌的主要危险因素[35]。其他可能的风险因素可能包括病毒感染、真菌感染和慢性牙周炎,而某些病例无法用任何已知的风险因素明确解释[36-37]。肿瘤内微生物群和肿瘤生物学之间的相互作用,特别是细菌对肿瘤的影响也越来越受到重视, 肿瘤内的细菌主要存在于细胞内,并且存在于癌细胞和免疫细胞中 [38]。口腔癌的发生也与细菌有关[39-40]。
OSCC与许多口腔细菌的携带有关(例如,P.gingivalis、具核梭杆菌), 它们可以通过促进上皮细胞增殖、同时抑制细胞凋亡和调节IM来刺激肿瘤发生。口腔微生物群的成员与食道癌、胃癌、胰腺癌、结肠/直肠癌和肺癌有关[41-42]。牙周炎被认为是最普遍的慢性口腔炎症性疾病之一,它能破坏牙周的支持组织,如果不及时进行治疗,最后可能会导致牙齿的脱落。牙周微生物群和宿主免疫细胞之间的相互作用诱导非保护性宿主免疫反应,从而触发宿主组织破坏。P.gingivalis的毒力因子影响宿主细胞内信号通路调节,以逃避宿主的免疫反应并干扰宿主癌细胞的正常死亡[43]。hang等人在研究中检测了50例OSCC患者的癌组织和相对健康组织的微生物群组成,发现OSCC样本中含有丰富的P.gingivalis,而携带这种细菌会使癌症发生的风险增加1.36(95% CI = 0.47-3.97),大多数癌症发生在牙龈。通过小鼠模型,也证明P.gingivalis增加了肿瘤的多样性和大小,并促进了肿瘤的进展[44-45]。
小结
1.OSCC病灶周围形成的“炎症微环境”主以 CD4+T 淋巴细胞为主,癌组织中 CCL20、CCR6 和 Foxp3 表达明显增高,并且三者之间有显著的正相关关系。
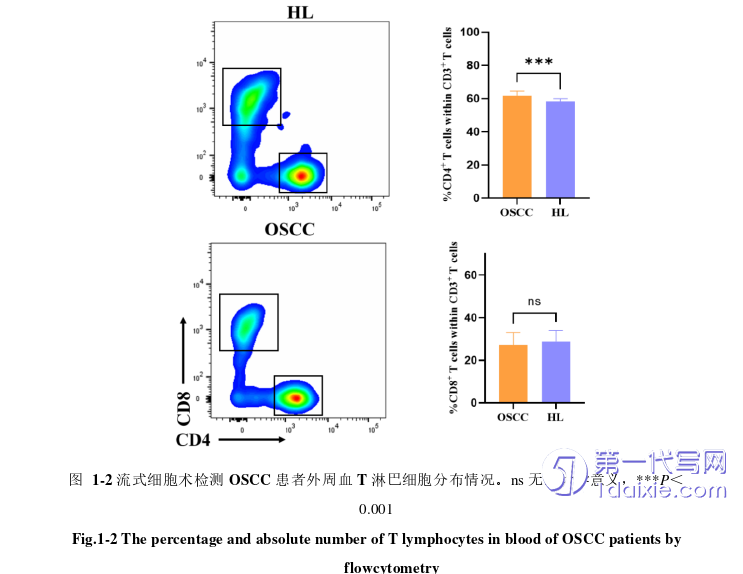
2. P.gingivalis促进肿瘤细胞分泌CCL20,通过CCL20-CCR6轴招募Treg细胞到OSCC的TME中,从而促进OSCC的恶性进展。
参考文献(略)
