本文是一篇医学论文,本研究根据KEGG数据库和盐单胞菌的盐胁迫转录组数据,分析发现H. campaniensis sp. XH26中Ectoine代谢的前体底物L-天冬氨酸-β-半缩醛存在分流途径。
第一章 前言
1.1 相容溶质Ectoine
高盐极端环境中生存的微生物必须具有产生与胞外基质相同渗透压的潜力(或至少相当)。当细胞内部渗透压低于周围环境的盐浓度时,可使细胞快速失水而死亡[1]。典型嗜盐细菌如盐红螺菌属(Halorhodospira)、色盐杆菌属(Chromohalobacter)、盐单胞菌属(Halomonas)和盐水杆菌属(Salinibacter)以及嗜盐古菌如盐盘菌属(Haloplanus)、盐棍菌属(Halorhabdus)和盐红菌属(Halorubrum)等,为了实现渗透压的稳定,通过自然进化已形成两种主要应对策略,策略一是:胞内积累K+和Cl-,可与介质中的离子浓度相平衡;其二是:胞外吸收与积累,或通过胞内生物合成低分子量有机中性的相容溶质(Compatible solute),以此防止细胞的水分损失[2-4]。微生物胞内可以积聚或合成不同的相容溶质,如糖类或糖苷类(海藻糖或葡萄糖苷)、氨基酸类(Glu、Pro和Gln)、甜菜碱类(甘氨酸甜菜碱、脯氨酸甜菜碱)、四氢嘧啶类(Ectoine与5-hydroxyectoine)以及乙酰氨基酸类(乙酰鸟氨酸与乙酰赖氨酸)等。研究表明,在1.5-3.0 mol/L NaCl浓度范围内,模式菌株盐单胞菌属(Halomonas)和色盐杆菌属(Chromohalobacter)可生物合成高浓度相容溶质[5-6]。在低盐条件培养菌株H. elongata DSM2581T,维持渗透压平衡的关键因素是K+浓度;而在高盐条件下,菌株通过吸收积聚谷氨酸钾盐,以维持渗透压平衡,又可通过胞内高浓度积聚相容溶质Ectoine提高菌株的耐盐性,致使菌株能在饱和盐水环境(> 3 mol/L,30% NaCl)中生存[7]。王魁荣等[8]通过探究菌株Halomonas sp. NY-011在不同盐离子培养基中耐盐生长的状态,发现缺少Cl-明显抑制菌株的耐盐生长,相比Li+与Mg2+而言,K+更优于平衡内部渗透压力。
1.2 Ectoine的代谢通路
近年来,高通量测序技术的迅速发展为全局性转录组学探索各种微生物的群体感应、表型差异、物质代谢及关键靶向基因调控提供技术支持[9]。目前,与以往的DNA测序技术相比,三代测序技术被用来研究转录组[10]。Ceylan等[11]通过盐胁迫转录组和蛋白组分析菌株Halomonas sp. AAD12的渗透压适应策略,发现运输关联蛋白质的显著差异表达与渗透调节、盐胁迫反应和能量产生密切相关。在大多数积聚Ectoine的嗜盐微生物中,Ectoine的合成严格依赖于盐环境。因此渗透压影响和各种次级代谢的合成网络,Ectoine的代谢通路尚未完全清楚 [1 2-1 3]。盐单胞菌胞内的Ectoine生物合成,依赖于保守的连锁基因簇ectABC或ectABCD-ask操纵子,合成前体底物与L-Asp和天冬氨酸半缩醛直接相关,而L-Asp与Asn、Glu或Gln等代谢通路存在关联[14]。诸多研究表明嗜盐菌胞内Ectoine的物质代谢通路为草酰乙酸→Asp→天冬氨酸-β-半缩醛→醛氨酸→草酰乙二氨基丁酸→N-γ-乙酰二氨基丁酸→Ectoine,其中天冬氨酸-β-半缩醛为重要的代谢节点,与草酰乙酸和Asp代谢关联[15-17]。
目前,主要通过大肠杆菌和谷氨酸棒杆菌宿主中构建异源合成途径,实现低盐度下高产Ectoine[1 8]。Zhao等[19]构建大肠杆菌基因工程菌后,以Asp为氮源底物进行补料发酵,结果显示相比对照菌株,Ectoine的总积累量提高3.1%。然而,李珊娜等[20]通过分析H. hydrothermalis Y2菌株在不同渗透条件下ectABC的启动子的表达,利用同源重组技术替换ectA启动子,敲除了Ectoine合成途径中逆向物质代谢的关键基因,构建突变体Y2/∆ectD/∆doeA,实现了Ectoine在低盐培养基11.5 g/L的高产。在设计高效底盘细胞方面,对盐单胞菌基因分子水平的修饰以降低其对高盐依赖性的研究非常有限。至此,利用高通量测序技术分析在不同盐胁迫条件下Ectoine生物合成全局性基因表达差异及其关联氨基酸(或衍生物)的代谢通路变化,值得深入探讨。
第二章 转录组学分析盐单胞菌Ectoine合成通路的关联基因
2.1 材料与方法
2.1.1实验材料
2.1.1.1 菌株来源与培养基
野生菌株H. campaniensis strain XH26 (CCTCC2019776M)分离于柴达木盆地小柴旦盐湖,可高积聚Ectoine,现保存于****基础医学研究中心。基础培养基(1L):NaC l 50 g(可调节),MgS O4·7H2O 25.0 g,KCl 55.0 g,CaC l2 0.2 g,柠檬酸钠3.0 g,L-谷氨酸钠6.5 g和酶水解酪素7.5 g,调节pH值8.0。固体培养基加入15 g/L琼脂粉[12]。
2.1.1.2 主要试剂和仪器
NaC l、KCl、MgS O4·7H2O、柠檬酸钠、酵母抽提物、L-谷氨酸钠、酶水解酪素和NaO H等均为分析纯(天津永大公司);乙腈(HPLC级)和Invitrogen Trizol试剂(美国赛默飞公司);细菌Ribo-Zeror RNA去除试剂盒(美国Illumina公司);Ectoine标准对照品(HPLC级>95%,德国Fluka分析公司);逆转录试剂盒(PrimeScript™ RT reagent kit with gDNA Eraser,RR047A)和qP CR试剂盒(TB Green® Premix Ex Taq™ II,RR820A,日本Takara公司);变速组织研磨器(OSE-Y50型,北京天根公司);高效液相色谱仪(HPLC-2100型,美国Agilent公司);色谱分析柱(SeQuant ZIC-HILIC,5 μm,150 mm×4.6 mm,德国Merck公司);微孔过滤器(0.22 μm水系膜,天津亳津公司);NanoD rop 2000微量检测仪(美国Thermo公司);Qubit 2.0 Fluorometer (美国Invitrogen公司);测序平台Illumina HiSeq 300PE(美国Illumina公司);实时荧光定量PCR仪(Roche Light Cycler®96,瑞士Roche公司)。
2.2 结果和分析
2.2.1 盐胁迫条件下Ectoine积聚量和生长差异分析
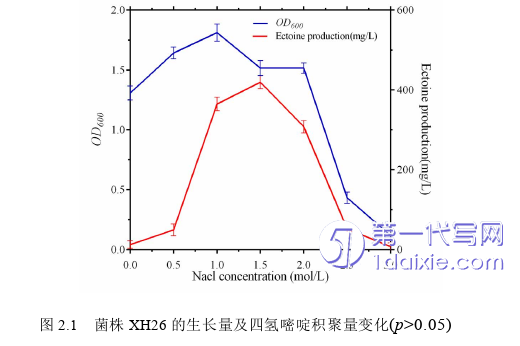
菌株H. campaniensis XH26的菌落形态为圆形、形态较小,乳白色、增殖快速、易粘连、隆起、湿润、边缘规则、不透明,革兰氏阴性,显微形态长杆状(3.0-5.0)μm×(0.5-0.75) μm,该菌株能适应高盐生长(0-3.0 mol/L NaCl),最适生长盐度1.0 mol/L NaCl,进入生长稳定期为培养时间为36 h(OD600值最大)。配置标准母液溶液(0.1 mg/L Ectoine)进行HPLC检测,建立浓度(x)与吸收峰面积(y)的变量关系,标准曲线为y=24912x+9.8195 (R2=0.9999)。
设置系列盐梯度条件0-3.0 mol/L NaCl (梯度间隔0.5),菌株XH26单批次培养36 h后,检测生长OD600值和HPLC分析胞内Ectoine积聚量(图1.1)。结果分析表明:当NaC l浓度为0-1.0 mol/L时,菌株XH26生长量呈上升态势;当NaC l浓度为1.0-3.0 mol/L时,菌株XH26生长量呈抑制态势,尤以NaC l浓度大于2.0 mol/L以后,生长量急剧下降。Ectoine积聚量分析显示:当NaC l浓度为0-1.5 mol/L时,Ectoine积聚量随盐度的升高而增加,积聚峰值为1.5 mol/L NaCl (即MS组);当NaC l浓度为1.5-3.0 mol/L时,Ectoine积聚量随盐度的升高而降低。此外,NS组、MS组和HS组的Ectoine积聚量均值(n=3)分别为130.0 mg/L、419.2 mg/L和52.1 mg/L。实验结果通过Spass v22.0进行标准差分析,结果无显著差异性(p>0.05)。
第三章 CRISPR/Cas9系统敲除Ectoine合成分流基因hom.................23
3.1 材料与方法.......................................23
3.1.1 实验材料.........................................23
3.1.2 方法...............................25
结论............................38
第三章 CRISPR/Cas9系统敲除Ectoine合成分流基因hom
3.1 材料与方法
3.1.1 实验材料
3.1.1.1 菌株、质粒和培养基
本实验主要菌株和质粒见表3.1。LB培养基(1L):胰蛋白胨10 g,酵母提取物 5 g,NaC l 10 g,调p H 7.0,高温灭菌20 min,固体培养基加入15 g琼脂粉。基础培养基(1L):NaC l 50 g(可调节),MgS O4·7H2O 25.0 g,KCl 55.0 g,CaC l2 0.2 g,柠檬酸钠3.0 g,L-谷氨酸钠6.5 g和酶水解酪素7.5 g,调节pH值8.0。固体培养基加入15 g琼脂粉[12]。
3.1.1.2 琼脂糖凝胶电泳缓冲液
①Tris-硼酸-EDTA缓冲液:10.78 gTris,5.5 g硼酸,0.93 g EDTA-Na溶于去离子水,定容到100 mL,用时稀释10倍。②EB溶液:溴化乙锭(10 mg/mL)(用时稀释10倍)。③加样缓冲液:50%甘油+0.25%溴酚蓝。④称取琼脂糖1 g,电泳缓冲液10 mL,蒸馏水90 mL,加热溶解,配制成1%琼脂糖凝胶;放凉后加入3至5滴EB溶液[51-52]。
3.1.1.3 SDS-PAGE凝胶电泳缓冲液
①30%凝胶贮备液:丙烯酰胺29.2 g,亚甲基双丙烯酰胺0.8 g,加超纯水至100 mL
②分离胶缓冲液(1.5 mol/L): Tris 18.17 g,加超纯水溶解,调p H 8.8,定容100 mL。浓缩胶缓冲液浓度为0.5 mol/L。
③电极缓冲液(pH 8.3):SDS l g,Tris 3 g,Gly 14.4 g,加超纯水溶解定容到1000 mL[53-54]。
结论
本研究利用转录组学高通量测序,比较分析了盐单胞菌H. campaniensis sp. XH26在不同盐度下差异基因的表达,并着重探讨了与Ectoine合成通路的相关差异基因。利用生物信息学手段挖掘出约1200个差异基因参与245个KEGG代谢途径,分析相关代谢网络得出Ectoine的主要生物合成通路(lysC+asd+ectABC)与Asp、天冬氨酸半缩醛代谢直接关联,主要代谢流又与上游Asn、Glu、Gln和Ala代谢网络密切关联。挖掘盐胁迫下Glu\His\Asp代谢网络中差异基因(gltB、gltD、davT 、hisD、alh-9、betA、acnB、pckA、gadA、lysC、asd和ectA BC)在Ectoine生物合成相关的碳/氮代谢流和三羧酸循环(琥珀酸、延胡索酸、草酰乙酸)的代谢网络位置整合重构为新的Ectoine合成通路,实现了Ectoine合成途径优化和代谢通路的整合。为解决Ectoine代谢网络比较复杂、多种氨基酸的交叉代谢及工业化Ectoine的超量产等问题提供了新的参考依据和解决方案,同时有可能为同类氨基酸(如色氨酸Trp、脯氨酸Pro)或其他天然化合物的工业化生产,提供参考性理论指导。
根据KEGG数据库和盐单胞菌的盐胁迫转录组数据,分析发现H. campaniensis sp. XH26中Ectoine代谢的前体底物L-天冬氨酸-β-半缩醛存在分流途径。基于CRISPR/Cas9系统敲除H.campaniensis sp.XH26基因组中与Ectoine合成相关的竞争性途径的关键基因hom,构建了基因缺陷菌株XH26/Δhom,在0.5mol/L低盐度条件下产量增加3.7倍及最适盐度1.5 mol/L NaCl条件下产量达到689.4 mg/L。敲除基因hom避免了Ectoine合成前体底物的转移,从而提高碳源利用率集中物质代谢流向Ectoine。本研究证实基因hom是Ectoine合成代谢分流途径中的一个关键基因,同时也说明敲除竞争途径中的关键基因可以有效地阻断合成底物代谢分流,实现高效生产。此外,本研究通过多次实验成功制备了菌株XH26的感受态细胞,为进一步改造盐单胞菌,构建系统的基因工程菌株,解决产量低的问题奠定了坚实的基础。
参考文献(略)
