本文是一篇医学论文,本论文研究证明TE诱导的调控机制与TSC体外维持培养中的调控机制是相同的,即VGLL1与TEAD4形成的复合物,通过调控组蛋白乙酰化修饰来调节细胞周期和TSC相关基因的转录活性,继而影响TSC的自我更新,此部分研究丰富了人类胚胎外谱系的认知,有助于研究和治疗与胎盘相关的疾病。
第一章 胎盘发育及功能
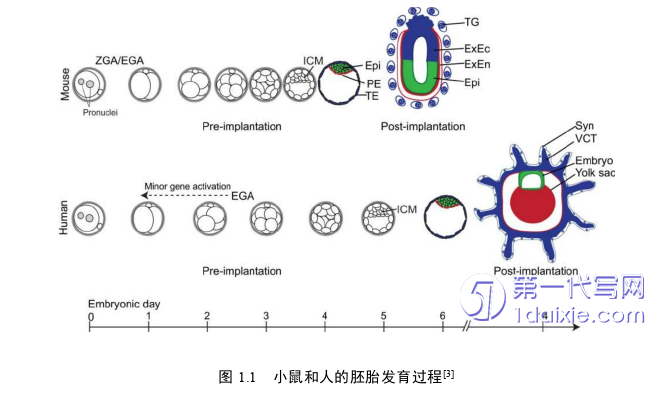
1.1 人和小鼠的胚胎发育过程
胚胎发育由合子开始经历一系列发育,随着时间发育会经历8细胞期、桑椹胚、囊胚期和原肠胚期,最终会发育成胎儿和胎盘结构[1-3]。小鼠和人类的胚胎发育是不完全相同的,小鼠胚胎发育合子基因激活表达于胚胎第1.5日左右的2细胞期,压紧和极化发生在胚胎第2.5天的8细胞期,TE和ICM分化是在胚胎第3.5日的囊胚期,第4日左右会形成成熟的囊胚,之后植入子宫,5-10天后开始内细胞团分化为三个胚层。然而,人胚胎发育合子基因组激活是发生在胚胎第3日的8细胞阶段,压实和极化是在第4.5日,在第5日开始分化形成TE和ICM,囊胚发育成熟在第7天时开始植入子宫(图1.1)[3-6]。人和小鼠的植入后发育也有不同,小鼠胚胎发育中,近端滋养外胚层(Polar TE)继续分化会发育成绒毛外滋养层外胚层(Extraembryonic ectoderm;EXEC),绒毛外滋养层内胚层(Extraembryonic endoderm;EXEN)和原代滋养巨细胞(Trophoblast giant cells;TGCs)等。人胚胎发育中,近端滋养外胚层(Polar TE),它分化为多核的合胞滋养层细胞(syncytiotrophoblast;SynTs)、合胞体滋养层细胞(cytotrophoblasts;CTBs),CTB分化成绒毛外滋养层干细胞(extravilloµs trophoblasts;EVT)和绒毛内滋养层干细胞(Visceral endedeom or villoµs cytotrophoblasts;VCTs)等。
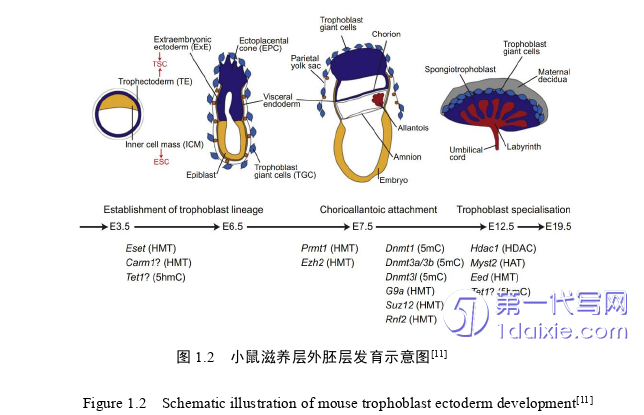
1.2 小鼠TE和TSC的发育过程及功能
哺乳动物胚胎发育是在囊胚阶段开始发生谱系分离,形成胚胎内细胞团(Inner cell mass;ICM)和滋养外胚层(TE)两个谱系[7,8],在随后的发育过程中,ICM继续生长发育成外胚层、中胚层(即被外胚层覆盖着一个原始内胚层或下胚层)、内胚层(即发育成形成胚胎内脏内胚层和顶叶内胚层)三个胚胎谱系[7,8]。围绕ICM整个结构的外部细胞构成TE,TE进一步会成长发育成胎盘和滋养层细胞,ICM和TE结构是复杂多样的(图1.2)。
小鼠胚胎发育过程中靠近ICM附近的TE细胞为近端滋养外胚层(polar TE),而与ICM不接触的TE细胞称为远端滋养外胚层(mural TE)[9]。远端滋养外胚层在滋养层分化中直接发育成滋养层巨细胞(Trophoblast giant cell;TGC),这些细胞会帮助之后的胎盘细胞的依附和入侵子宫壁(图1.2)[4,5,10]。
第三章 调控TE和TSC诱导分化机制的概述
3.1 HIPPO信号通路在小鼠TE中的调控机制
报道称HIPPO信号活性是导致小鼠早期胚胎分化成ICM和TE两大谱系的主要触发因素[54,55]。桑葚胚内部的细胞表面张力较低时,HIPPO信号开启,而在表面张力较高的TE中HIPPO信号通路是关闭的,胚泡内外细胞之间的极性和粘附性差异也会限制HIPPO信号通路的表达[28,54],即此信号通路有YAP-TEAD4结合驱动CDX2表达等。
HIPPO信号通路在小鼠TE和ICM分化中起着关键的作用[28,56]。由小鼠胎盘滋养层细胞谱系可知,关键转录因子Cdx2、Eomes、Elf5可在体外通过外源性成纤维细胞生长因子和各节点信号来诱导和维持TSC细胞生长[50,57-59]。信号级联分子和信号通路相关激酶与转录因子整合,来控制TSC的自我更新和分化之间的平衡[4,5,29]。TSC的分化过程是由CDK的特异性抑制剂p57和p21调控,而p57定位于细胞核通过抑制Cdk1,p21使TGC发生有丝分裂定位于细胞质并阻止TGC进行细胞凋亡[60]。
小鼠TE的关键调控基因如Yap1、Tead4、Cdx2等,其中Cdx2编码的转录因子仅限于滋养层细胞中表达,研究表明这是通过TE中的HIPPO信号通路关闭,从而导致转录辅因子YAP进入细胞核定位,然后与转录因子TEAD4相互作用以驱动CDX2表达[54,61,62],Notch信号通路在此过程与HIPPO途径是平行的,也有助于Cdx2表达[61]。在小鼠TE和TSC中,Cdx2的表达由关键因子Eomes、Elf5、Ets2和Tcfap2c等组合成的正反馈环得以进一步维持TE/TSC的诱导分化,这些转录因子有助于稳定滋养层细胞谱系[4,5,48,63-65]。
3.2 HIPPO信号通路在人TE和TSC中的有关研究报道
小鼠TE中Vgll1表达量很低,但在人的TE里VGLL1是高表达的,且VGLL1和TEAD4在人类TE中可能有相互作用[51,63]。然而关于VGLL1在人类TE中的功能知识了解非常有限,仅有报道称VGLL1是一个在人类CTBs中有趣的特异性调控基因[51,70],却未有关于VGLL1更深入的报道。有研究提出Tead4/Yap1在小鼠中建立的是一个基本的基因表达程序,而在人类CTBs中,可能存在一个不同于小鼠的基因调控程序[4,48,51,71]。有文章报道VGLL1在人和小鼠两个物种的胎盘妊娠分化的不同定位和表达模式,在人胎盘的早期妊娠样本中,绒毛状CTBs和近端细胞柱(pCC)滋养层中VGLL1高表达。VGLL1和TEAD4在妊娠期的CTBs中均保持表达,但与TEAD4不同的是VGLL1在成熟EVT中也有表达。后来进一步证实了人VGLL1在CTBs中的表达,分离的原代CTBs显示出高表达水平的VGLL1蛋白,但在CTBs细胞分化后表达下降[51]。然而,目前尚不清楚人TE中VGLL1、TEAD4对TSC分化的具体调控机制,值得注意的是,小鼠TE中Yap1、Tead4、Cdx2调控机制,并不适用于人TE的调控机制,因为CDX2基因在人TE中的表达量较低。YAP1在人类naïve hESCs分化有重要作用,[48,72],但是人TE中的VGLL1、TEAD4、YAP1在naïve hESCs向TE/TSC诱导过程中的作用机制还有待进一步研究。
在人TE/TSC中,HIPPO信号通路中的关键转录因子在原始干细胞的分化和TE/TSC滋养层干细胞中可能起到与小鼠不同的作用,人的滋养层干细胞中CDX2不位于细胞核[38],且其表达量比较低[38],EOMES也未表达,但人TE/TSC中LAST1/2和YAP1是表达的,当过表达CDX2时,发现并不影响滋养层干细胞的自我增殖,同时滋养层干细胞的形态、标志基因的表达并没受影响[28,73-75]。有文章报道牛、大鼠的TE细胞中YAP大多在细胞质[76-78],但在人的TE细胞中YAP定位尚未有明确报道。
第三章 VGLL1在人TSC维持培养与TE诱导过程中机制是否具有同一性的研究 ..................... 67
3.1 实验材料与试剂 ...................................... 67
3.2 实验方法 ............................ 67
3.3 实验结果 ................................ 68
3.4 讨论............................. 76
3.5 小结........................................ 76
结论 .......................... 77
3.4 讨论
TSC是由TE进一步发育形成的具有分化能力且可扩增的细胞,为了扩展我们对TSC和胚胎外谱系发育的理解,此部分进一步探索了TE诱导的调控机制在TSC维持培养中是否同样适用。结果证明TE诱导的调控机制与TSC体外维持培养中的调控机制是相同的,即VGLL1与TEAD4形成的复合物,通过调控组蛋白乙酰化修饰来调节细胞周期和TSC相关基因的转录活性,继而影响TSC的自我更新,此部分研究丰富了人类胚胎外谱系的认知,有助于研究和治疗与胎盘相关的疾病。
另外,此机制或许可以被用于牛、猪、羊等家畜的胎盘发育研究。牛和其他反刍动物中,母胎之间的交流主要也是发生在胎盘及其附属物(Hongen xu rt al., 2017),虽然牛和人的胎盘发育遵循着物种间存在差异,但不同物种间存调控的具体差异,具体如何调控需进一步探索。若牛、羊等家畜动物的胎盘发育机制研究取得大的进步,这将是解决由于胎盘发育不成熟或胎盘老化造成牛、羊、猪等动物早产、产死胎、木乃伊胎、弱崽等问题的福音,如此将增加产仔率和幼崽的存活率,将推动畜牧业的健康发展。此外,如珍贵动物熊猫,其产的幼崽极小且难存活,幼崽存活率低,后天对各有害环境的免疫力、各种慢性疾病的易感性均与胚胎发育期间胎盘发育是否正常相关,如果能研究清楚这些濒危动物的滋养外胚层细胞的调控机制,将有利于解决由于胎盘发育异常所导致的幼崽死亡等,这将缓解濒危动物的部分压力。
结论
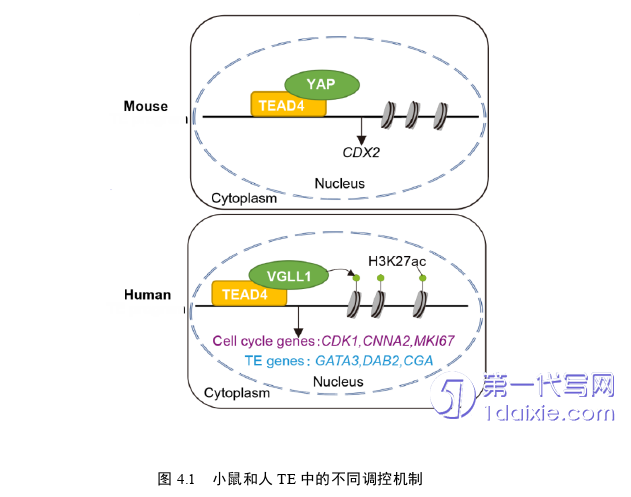
本论文研究发现VGLL1是人TE诱导和TSC维持培养中的特异性调控因子。VGLL1与转录因子TEAD4结合成复合物通过调控组蛋白乙酰化修饰调节下游MKI67、CDK1、CCNA1等细胞周期基因和GATA3、CGA等TE相关基因的染色质开放性,进而激活TE的诱导和自我更新的程序;TEAD4转录因子在小鼠和人TE发育阶段招募不同的转录辅因子,在小鼠TE中是YAP-TEAD4复合物的共同作用然后调节下游靶基因Cdx2转录活性,在人TE是VGLL1-TEAD4结合成复合物(图4.1)。
参考文献(略)
