本文是一篇医学论文,本研究经过分析,得出结论:NLR1、LMR、接受二线治疗方案、≥3个转移部位是接受ICIs治疗的晚期NSCLC患者预后的独立影响因素。
第2章资料与方法
2.1一般资料
本研究采用回顾性研究方法,从2019年1月至2022年10月期间于南昌大学第二附属医院及南昌大学第一附属医院接受ICIs治疗的晚期NSCLC患者中,通过纳排标准筛选出符合要求的患者共72例,其中男性患者60例,女性患者12例,年龄在31岁至88岁之间,通过电子病历系统收集患者的相关资料。
2.2病例纳入及排除标准
2.2.1纳入标准
(1)经组织学或细胞学诊断为非小细胞肺癌,且根据国际抗癌联盟(UICC)第8版TNM分期为Ⅲb~Ⅳ期的患者(2)患者同意治疗方案,且为首次进行PD-1/PD-L1抑制剂治疗,疗程≥2周期(3)美国东部肿瘤学协作组(ECOG)评分为≤2分(4)预计生存期大于3个月(5)年龄大于18周岁
2.2.2排除标准
(1)伴随其他部位的原发肿瘤(2)无影像学资料评价治疗效果(3)首次ICI治疗前1月内无血常规检查结果(4)合并血液系统、免疫系统疾病(5)长期应用糖皮质激素、免疫抑制剂治疗(6)治疗期间出现严重骨髓抑制,予集落刺激因子治疗(7)数据收集前3周内有感染
第3章结果
3.1纳入患者的一般基线资料
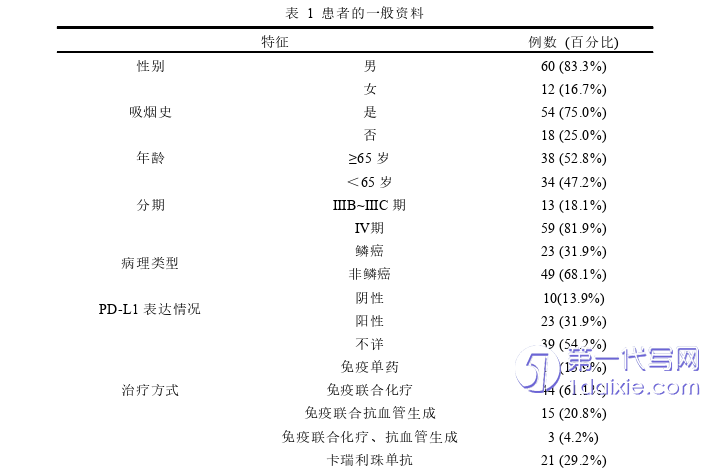
如表1所示,共纳入接受ICIs治疗的晚期NSCLC患者72例,其中男性60例(83.3%),女性12例(16.7%);有吸烟史的患者54例(75.0%),无吸烟史患者18例(25.0%);年龄31~88岁,中位年龄65(58,70.75)岁,其中≥65岁有38例(52.8%),<65岁有34例(47.2%);非鳞癌共49例(68.1%),肺鳞癌患者23例(31.9%),其中IIIB~IIIC期患者共13例(18.1%),IV期患者59例(81.9%);PD-L1表达阴性患者共11例(15.3%),表达阳性患者23例(31.9%),表达不详的患者共38例(52.8%);使用免疫药物单药治疗的患者10例(13.9%),联合化疗共44例(61.1%),联合抗血管生成共15例(20.8%),联合化疗及抗血管生成共3例(4.2%),其中使用卡瑞利珠单抗共21例(29.2%),帕博丽珠单抗共18例(25.0%),信迪利单抗共16例(22.2%),替雷利珠单抗共12例(16.7%),纳武利尤单抗共2例(2.8%),阿替利珠单抗共3例(4.2%);接受一线治疗共61例(84.7%),≥二线治疗共11例(15.3%);转移数目≥3个的患者有30例(41.7%),<3个的患者有42例(58.3%);按照NLR1进行分组时,≥5.73的患者有20例(27.8%),<5.73有52例(72.2%);按照LMR进行分组时,≥2.48有31例(43.1%),<2.48有41例(56.9%);按照PLR进行分组时,≥169.97有39例(54.2%),<169.97有33例(45.8%);按照SII进行分组时,≥812.93有40例(55.6%),<812.93有32例(44.4%)。
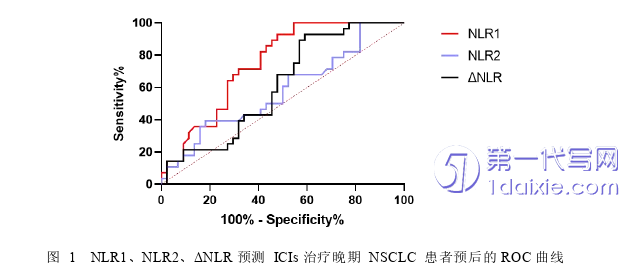
3.2 NLR、LMR、PLR、SII最佳截断值选取及分组
将各研究指标绘制ROC曲线,应用曲线下面积(area under the curve,AUC)评价其对预后的预测价值。图1所示为NLR1、NLR2、ΔNLR预测ICIs治疗晚期NSCLC生存结局的预测能力。NLR1曲线下面积为0.749(95%CI::0.639~0.859,P<0.05),最大约登指数0.455,所对应NLR1值为5.73,此时敏感度为0.455,特异度为1。因此,取5.73为NLR1的最佳截断值。根据NLR1将患者分为高NLR1组(≥5.73)及低NLR1组(<5.73)。NLR2、ΔNLR曲线下面积分别为0.580(95%CI:0.443~0.716,P=0.258)、0.612(95%CI:0.482~0.742,P=0.111),无统计学意义,不予取截断值。
根据LMR、PLR、SII的值绘制ROC曲线,分别如图2、图3所示。LMR的曲线下面积为0.746(95%CI:0.628~0.863,P<0.05),最大约登指数0.464,所对应LMR值为2.48,此时敏感度为0.750,特异度为0.714。因此,取2.48为LMR的最佳截断值,根据LMR将患者分为高LMR组(≥2.48)及低LMR组(<2.48)。PLR曲线下面积为0.731(95%CI::0.614~0.849,P<0.05),最大约登指数0.419,所对应PLR值为169.67,此时敏感度为0.705,特异度为0.714。因此,取169.67为PLR的最佳截断值。根据PLR将患者分为高PLR组(≥169.67)及低PLR组(<169.67)。SII的曲线下面积为0.722(95%CI:0.604~0.839,P<0.05)最大约登指数0.384,所对应SII值为812.93,此时敏感度为0.705,特异度为0.679。
第3章 结果....................... 7
3.1 纳入患者的一般基线资料 ...................................... 7
3.2 NLR、LMR、PLR、SII 最佳截断值选取及分组 ........................ 9
3.3 ICIs 治疗晚期 NSCLC 患者 PFS 的影响因素分析 ................. 12
3.4 ICIs 治疗晚期 NSCLC 患者 OS 的影响因素分析 .................. 16
第4章 讨论................................... 20
第5章 结论.......................... 24
第4章讨论
随着对肿瘤免疫逃逸机制的深入了解,免疫治疗已广泛应用于各种实体瘤及血液系统肿瘤的治疗,彻底改变了肿瘤治疗领域的面貌。在晚期非小细胞肺癌患者中,ICIs更是成为驱动基因阴性人群的一线治疗方案[5]。免疫检查点是对机体免疫反应进行负调节的一种蛋白质,对于维持自身耐受、防止自身免疫、避免免疫细胞过度激活有着至关重要的作用[25,26]。PD-1的主要作用是在炎症反应时限制外周组织中T细胞的活性,避免自身免疫,其表达于活化的的T细胞、B细胞、NK细胞、巨噬细胞等多种免疫细胞。肿瘤细胞通过上调PD-L1表达与PD-1结合,抑制T细胞免疫反应[6,27]。在肿瘤微环境中,肿瘤细胞正是通过上调抑制性检查点的表达、招募免疫抑制细胞和因子到肿瘤微环境,以及减少肿瘤免疫原性抗原的呈递,将免疫微环境塑造成免疫抑制状态,逃避机体的抗肿瘤反应[28]。2002年,Iwai等[7]开创性地证明了肿瘤细胞PD-L1和细胞毒性T淋巴细胞上PD-1之间的相互作用,可导致肿瘤生长加速;使用抗PD-L1抗体治疗或者敲除荷瘤小鼠中的PD-1,将延缓肿瘤生长。在随后进行的一系列临床研究中,也证实PD-L1表达增加与肿瘤患者不良预后相关。例如,Thompson等[29]对197名肾细胞癌患者B7-H1表达情况进行分析后发现,肿瘤和/或淋巴细胞B7-H1水平高的患者死于肿瘤的风险是B7-H2表达水平低的患者的4.5倍(HR4.53;95%CI:1.94-10.56;P<0.001)。Ohigashi等[30]在食管癌患者也得出了类似的结论:PD-L1及PD-L2表达阳性的患者术后1年总生存率明显低于表达阴性的人群。2011年,伊匹木单抗作为首个被批准用于治疗肿瘤的ICIs开始应用于恶性黑色素瘤的治疗。随后几年间,免疫治疗开始寻迅猛发展,多种针对PD-1/PD-L1信号通路的药物相继问世,彻底改变了恶性肿瘤的治疗现状[31]。
第5章结论
(1)NLR1、LMR、接受二线治疗方案、≥3个转移部位是接受ICIs治疗的晚期NSCLC患者预后的独立影响因素
(2)NLR1≥5.73、接受二线治疗方案、≥3个转移部位与更短的PFS相关,NLR1≥5.73、接受二线治疗方案与更短的OS相关。LMR为预后的保护性因素,治疗前LMR≥2.48与更长的PFS、OS相关。
参考文献(略)
