本文是一篇医学论文,在本研究中,我们发现了 AURKA 在主动脉夹层动脉瘤中促进 VSMC 增殖和迁移中的生物学功能。首先,我们发现 AURKA 在 ADA 组织中表达显着增加,尤其是在破裂的 ADA 组织中更高。其次,AURKA 促进 VSMC 增殖和迁移的作用。第三,AURKA 的下调抑制了 AngII 诱导的 VSMCs 的增殖和迁移。最后,在VSMC 增殖和迁移中对 AURKA 的调节需要 GSK-3β/β-catenin 信号通路的参与。首次发现 AURKA 在 VSMC 表型转化调控中的作用,并且可能是 ADA 治疗的潜在分子靶标。
第 1 章 实验研究
1.1 研究对象及材料
1.1.1 研究对象
收集 2016 年 1 月至 2019 年 6 月在河北医科大学第四医院确诊并治疗的 43 例ADA 患者的血管样本及临床资料,所有样本病理诊断均由两名经验丰富的病理学家确认作为病例组。ADA 患者包括 29 位男性和 14 位女性,年龄 22 至 74 岁,按照 ADA 是否破裂分为 ADA 组(n=31)和 ADA 破裂(RADA)组(n=12)。从器官供体中选择非 ADA 人员作为对照组(n=11)。每位外科手术患者在捐赠组织之前均已签署知情同意书。该研究得到河北医科大学第四医院伦理委员会(2016 [37])和华北理工大学伦理委员会的批准。
1)病例组的纳入标准
(1)来源于河北医科大学第四医院的汉族患者; (2)临床资料完整且知情同意参与本研究; (3)诊断结果明确为 ADA; (4)术前未行化学治疗及放射治疗。
2)病例组的排除标准
(1)既往有除 ADA 以外的其他心血管疾病的患者; (2)临床资料不全者
3)对照组的纳入标准
(1)来源于同期器官供体中的非 ADA 主动脉壁组织标本; (2)与实验组标本年龄、性别和主动脉部位相匹配。
4)对照组的排除标准
(1)既往有 ADA 病史的患者; (2)既往诊断患有严重心血管疾病的患者; (3)与实验组对应部位的组织不够完整。
1.2 研究方法
1.2.1 小鼠主动脉血管平滑肌细胞的培养
小鼠主动脉血管平滑肌细胞(编号 CRL2797™;来源于美国菌种宝藏中心(american type culture collection,ATAA)在含有 100 单位.mL-1 青霉素的低葡萄糖Dulbecco 改良 Eagle 培养基(Gibco, Life Technologies,美国)中常规培养,在37°C , 5%CO2 的 加 湿 培 养 箱 中 , 加 入 100μg.mL-1 链 霉 素 和 10% 胎 牛 血 清(GEMINI,美国)。每两天更换生长培养基,并在 80%汇合时以 1:4 的比例每四天传代一次细胞。AngII(10-7 摩尔;Sigma-Aldrich)用于处理 VSMC 24 小时。
1.2.2 细胞转染
相关步骤请参阅 Lipofectamine®2000 试剂说明书。本研究使用了 Lipofecta mine 2000 进行转染小鼠主动脉血管平滑肌细胞。
1)首先,将细胞接种到孔板或细胞培养瓶中,在 37°C 和 5%CO2 条件下培养24 小时,显微镜下观察,细胞贴壁生长,并待细胞生长至 70%左右的密度时进行转染;
2)将 RNA 稀释终浓度至 50pmol.mL-1,Lipofecta mine 2000 或 RNA 溶解在无血清无因子的 DMEM 培养基中,充分混合并将两者混合。短暂离心,然后在室温下静置 10 分钟;
3)用双无的 DMEM 培养基洗涤细胞两次,然后替换为新鲜的无血清无因子和无抗生素的 DMEM 基础培养基;最后,将脂质体的混合物加入其中。根据培养细胞的体积,轻轻摇动后放置 37°C 下培养;
4)转染 6 小时后,倒掉原来的培养基并换成含 2.5%FBS 的 DMEM 并进行培养,37°C 下培养 24 小时后,自细胞培养箱取出,收集细胞并提取 RNA 或进行Western Blot 等分析。
第 2 章 综述 AURKA 的功能和在疾病中的研究进展
2.1 Aurora 激酶的结构及生成
2.1.1 Aurora 激酶的结构
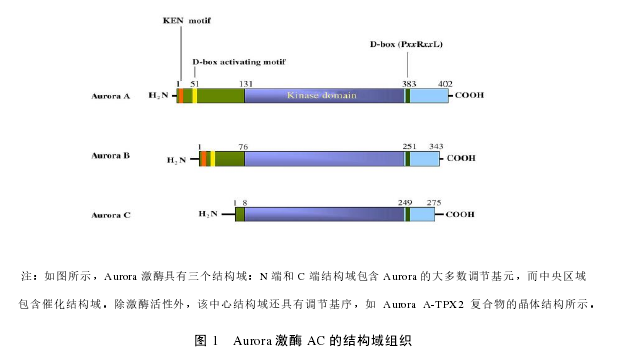
Aurora 激酶 A~C 具有相似的域结构:长度为 39~129 个残基的 N 末端结构域,蛋白激酶结构域和 15~20 残基的短 C 末端结构域(图 1)。 Auroras A~C 的 N 末端结构域具有低序列保守性,这决定了蛋白质与蛋白质相互作用期间的选择性[38]。对于人类对应物,Aurora 激酶 A~C 的催化结构域更为保守。在 Aurora C 中已鉴定出 PEST 样的基序。该基序的突变位于 N 末端,显着消除了 Aurora C 激酶的活性[37]。还已经确定,小鼠 Aurora C 的主要磷酸化位点是苏氨酸 171,其被蛋白激酶A 磷酸化。Auroras A 和 B 的比对可以鉴定一个跨越 11~18 个残基的远距离保守的“KEN”基序。“KEN”充当依赖 Cdh1 的后期促进复合物(APC)识别信号。人类 Auroras B 的 C 末端结构域分别与人类 Auroras A 和 C 具有 53%和 73%的序列相似性。人 Auroras A 的晶体结构与根据人 Auroras B 和 C 的氨基酸序列预测的晶体结构的比较也支持这样的观点,即脊椎动物 Auroras B 和 C 是紧密相关的旁系同源物[39]。
2.2 AURKA 的功能
2.2.1 AURKA 在中心体及有丝分裂中的作用
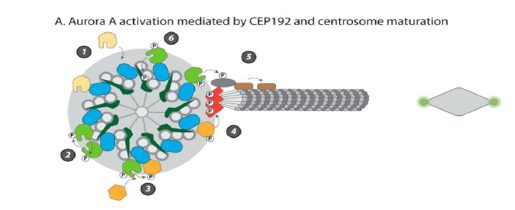
1)Aurora 激酶参与 G2 和 M 期的细胞周期进程 通过不同方法干扰 Aurora A 都会导致有丝分裂纺锤体组装缺陷,从单极纺锤体到双极纺锤体。激酶在中心体上的位置导致结论:AuroraA 在有丝分裂纺锤体组装过程中调节中心体功能。实际上,使用单特异性抗体的首次研究表明,在 S 期结束时,Aurora A 蛋白激酶库开始位于复制的中心体上。在 G2 阶段,在称为中心体成熟的过程中,激酶在中心体上的高度富集与大量周围周质物质(PCM)的募集相吻合,这一事件也称为中心体成熟[44-47]。中心体成熟以中心体上 γ-微管蛋白环复合物(TuRC)的积累为标志,然后促进了广泛的微管(MT)成核[48-49]。在大多数情况下,此事件对于确保双极化和纺锤体细胞中纺锤体的正确时空组装至关重要。PCM 由许多彼此相互作用的高分子量蛋白质组成,构成锚定 TuRC 的更大结构[50-51]。
由于 PCM 组装不是线性的,并且某些蛋白质对其募集是共依赖性的,因此中心体成熟研究一直很困难。此外,PCM 组装和 MT 成核表现出多种差异,具体取决于模型生物和研究其生物发生的方法。但是,对果蝇,非洲爪蟾和人类细胞等多个系统的研究表明,Aurora A 是中心体成熟过程中的关键角色[52-56]。 Aurora A 在中心体的定位取决于是否存在称为线圈缺陷蛋白 2(Spd-2)的大型卷曲螺旋蛋白(脊椎动物中的中心体蛋白 192(Cep192)),该蛋白被募集到中心体中[52, 54, 55]。在非洲爪蟾中,这种大蛋白具有 Aurora A 结合结构域,并且在另一侧具有非洲爪蟾 Polo 样激酶 1(Plx1)的停靠位点。Spd-2 的募集触发了 Aurora A 分子的后续局部富集,该过程足以通过位于催化域中的保守苏氨酸上的激酶反式自动磷酸化来促进 Aurora A 二聚化和激活。随后,Aurora A 通过磷酸化其激活环来触发 Plx1 的激活。然后,Plx1 通过 Polo 盒在先前由细胞周期蛋白依赖性激酶 1(CDK1)/ CyclinB 引发的位点上通过 Polo 盒对接[52]。在人类中,Polo 样激酶 1(Plk1)与Cep192 的对接也依赖于另一个磷酸化位点的存在(在不存在 Aurora A 的情况下),因此似乎是双峰的[57-58]。引人注目的是,XlSpd-2(非洲爪蟾)没有为 TuRC 的直接募集提供结合位点,表明在体外没有重要的因子。
第 2 章 综述 .................................... 34
AURKA 的功能和在疾病中的研究进展 ...................................... 34
2.1 Aurora 激酶的结构及生成 .................................... 34
2.1.1 Aurora 激酶的结构 ........................................ 34
2.1.2 Aurora 激酶合成与降解 .................................... 35
2.2 AURKA 的功能 ............................................. 35
2.2.1 AURKA 在中心体及有丝分裂中的作用 ....................... 35
2.2.2 AURKA 在非有丝分裂中的功能 ................................. 39
2.4 设计未来 AURKA 特异性抑制剂
经过 20 年的设计和测试 AURKA 抑制剂,人们常常质疑实际策略的针对性。尽管这些化合物通过在有丝分裂的早期阶段阻断其在 Thr288 上的自磷酸化来抑制AURKA 的活化,但越来越明显的是,AURKA 的某些作用不需要其激酶活性,而且该细胞外还没有发现该激酶的许多新作用。以此看来,靶向 AURKA 的单个池,尽管丰富且活跃,但限制了该蛋白发挥的过多功能及其多种激活方式。另外,AURKA 既可以作为癌基因也可以作为肿瘤抑制物,并且以组织特异性方式发挥作用[181]。因此,使该激酶失活可以阻断在特定组织中某些肿瘤的发展,在该组织中它充当癌基因,并在细胞和组织中触发其他肿瘤的发作,在该细胞和组织中它起到抑癌作用。替代 ATP 类似物的下一代替代策略已开始在该领域面临:阻断激酶与其激活剂之间的蛋白质-蛋白质相互作用。该策略最近已在体外采用,其中分离了四种阻止 AURKA 和 TPX2 之间相互作用的化合物[182]。一个令人兴奋的观点可能是将该方法与虚拟筛选相结合,同时考虑到激酶的形状和静电荷[183]。使用能够在活细胞中显示基于 FRET 的抑制性读数的构象敏感探针,荧光显微镜还可以在体内提供帮助。但是,要考虑的关键参数是 AURKA 可以被几种蛋白质激活并在不同的细胞器中激活。如果这增强了结合使用计算机/体外/细胞内联合方法检测激酶对特定亚细胞库的抑制作用的相关性,则多种相互作用物对 AURKA 的激活可能会增加相关物质发现的复杂性用于抗癌治疗。
2.5 结论与观点
近 20 年以来,我们对 AURKA 的非有丝分裂作用的理解有了重大进步,这是因为定量显微镜技术已成为 FRET 显微镜[143, 151]。超分辨率显微镜技术作为单分子定位显微镜(SMLM)的兴起[184]可能再次在不久的将来彻底改变我们对 AURKA亚细胞定位的理解。但是,SMLM 技术目前需要较长的采集时间,并且在很大程度上适用于固定样本,而不是用于快速事件的检测。解决方案可以是使用结构照明显微镜(SIM)或可商购的图像扫描显微镜方法[185]。确实,图像扫描显微镜方法已经被用来更好地观察动植物的 AURKA[186],但是与 SMLM 获得的分辨率 10~20 nm 相比,获得的分辨率仅为 120 nm 左右[187]。两者合计,如何从时空分辨的活性测定中受益,如 FRET 生物传感器,并提高体内分辨率?有鉴于此,通过 FLINC的 FRET 与称为光致变色随机光学起伏成像(pcSOFI)[188-189]的超分辨率显微镜技术相结合,已经可以用来评估多功能激酶 PKA 的活性和活细胞中的 ERK。可以想象这样的方法可以扩展到 AURKA FRET 生物传感器,以检测其激活和其活性。这样就可以实时,高分辨率地了解 AURKA 的激活或活动。
另外在本研究中,我们发现了 AURKA 在主动脉夹层动脉瘤中促进 VSMC 增殖和迁移中的生物学功能。首先,我们发现 AURKA 在 ADA 组织中表达显着增加,尤其是在破裂的 ADA 组织中更高。其次,AURKA 促进 VSMC 增殖和迁移的作用。第三,AURKA 的下调抑制了 AngII 诱导的 VSMCs 的增殖和迁移。最后,在VSMC 增殖和迁移中对 AURKA 的调节需要 GSK-3β/β-catenin 信号通路的参与。首次发现 AURKA 在 VSMC 表型转化调控中的作用,并且可能是 ADA 治疗的潜在分子靶标。
参考文献(略)
