本文是一篇医学论文,在本课题研究中,我们继续围绕p53如何调控XRCC1聚集至UV损伤位点来进一步挖掘p53在UV损伤应答中的分子机制。
第二章 实验材料与方法
2.1 实验材料
2.1.1 菌株及细胞株
1)宿主菌:大肠杆菌 DH5α,BL21(本实验室冻存) 2)细胞系:U2OS 细胞,HCT116 细胞,HCT116 p53-/-细胞(本实验室冻存) 2.1.2 质粒载体 pCDNA5质粒,pCMV 质粒
2.1.3 主要试剂
1)高糖DMEM(美国 Gibco 公司) 2)胰蛋白酶(武汉博士德生物工程有限公司) 3)南美胎牛血清(美国 Gibco 公司) 4)青链霉素混合液(100×)(北京 Solarbio 公司) 5)BIOMYC-3(以色列 Biological Industries 公司) 6)Lipofectamine 2000 转染试剂(美国 Thermofisher 公司) 7)Zeocin(美国 Invitrogen 公司) 8)G418(德国 Calbiochem 公司) 9)Hygromycin B(31282-04-9,上海aladdin 公司) 10)Kanamycin Sulfate(0G270G27,南京生兴生物公司) 11)Ampiclllln,Sodium Salt(3F203F20,南京生兴生物公司) 12)Protease Inhibitor Cocktail Tablets(04 693 132 001,美国Roche公司) 13)Dynabeads protein G(美国 Invitrogen 公司) 14)Proteinase K(3K210K14,南京生兴生物公司) 15)Nonidet P 40 Substitude(1210600,南京生兴生物公司) 16)2-MERCAPTOETHANOL(35288019,美国 amresco 公司) 17)Tween-20(1K122C12,南京生兴生物公司) 18)Triton X-100(1A141A14,南京生兴生物公司) 19)甘油(G8190,北京 Solarbio 公司) 20)3M NaAc buffer solution PH5.2(1C211C21,南京生兴生物公司)
2.2 实验方法
2.2.1 载体构建及稳转细胞筛选
1.pCMV-FLAG-XRCC1重组载体的构建
1)酶切:将本实验室中分别含有pCMV-FLAG、XRCC1片段的载体进行酶切,37℃ 3h;
2)酶切产物回收:将酶切产物进行琼脂糖凝胶电泳,在紫外灯下将含DNA片段的凝胶切下,通过凝胶回收试剂盒回收DNA片段;
3)连接:加入T4 DNA ligase室温连接过夜;
4)转化:将1-2μl连接产物加入20μl感受态细菌中,冰浴30min,42℃热激45s;迅速冰浴2min;在超净操作台中加入500μl 无菌LB培养基,37℃摇床培养2h;3000 rpm离心5min,弃上清,约留50-100μl吹匀沉淀涂布到琼脂培养板中(含氨苄或卡那霉素),倒置平皿于37℃培养箱,培养16h后出现菌落。挑取培养板上的单个菌落, 接种于3 ml 含抗生素LB培养基中,于37℃ 250rpm摇床振荡培养过夜(>12h)。
5)质粒提取鉴定:依据Axygen试剂盒中的步骤进行质粒小提。分光光度计测其浓度后,对重组质粒进行双酶切,确定重组质粒构建是否成功;
6)去内毒素处理:根据 Axygen 去内毒素试剂盒操作。
第三章 实验结果
3.1 p53通过蛋白质相互作用调控XRCC1的聚集
3.1.1 p53蛋白与XRCC1存在蛋白质相互作用
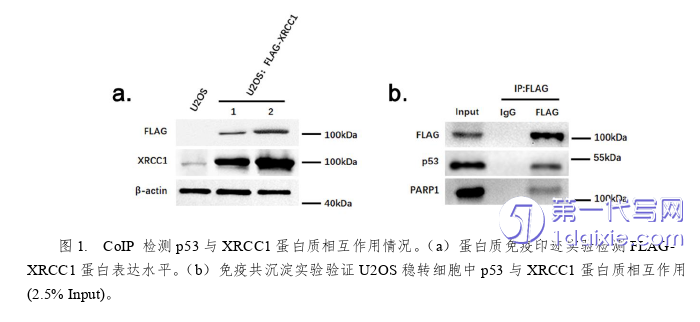
我们首先讨论细胞内p53蛋白与XRCC1是否存在相互作用。在本实验中我们选择U2OS细胞株为实验对象。由于本实验室的XRCC1抗体不能用于免疫共沉淀,因此我们构建了一个外源稳转FLAG-XRCC1的U2OS细胞系。我们首先重组构建了pCMV-FLAG-XRCC1质粒,通过脂质体转染至U2OS中,通过G418抗生素筛选得到两个阳性克隆细胞群, Western Blot结果显示,与对照(U2OS)细胞相比,两株稳转细胞系均有明显过表达(图1a),我们挑选了1号细胞系作为我们后续CoIP实验的对象。
3.2 XRCC1在UV损伤位点的富集动态变化
为进一步探讨p53和PARP1两种不同途径对XRCC1聚集影响及其相互关系,我们对细胞进行亚细胞组分分级处理,将其分为染色质组分和胞质、可溶性核质组分,并用β-actin和Histone H3 蛋白作为内参检测亚细胞组分分级效果(图5c)。我们分别用HCT116和U2OS细胞进行亚细胞组分分级,检测UV照射后XRCC1在染色质上富集的动态变化情况。
3.2.1 XRCC1蛋白在损伤位点的富集随UV照射剂量的增加而增加
首先探讨了UV照射剂量对XRCC1在染色质上富集的影响,选取了15J/m2、30J/m2、90J/m2 3个剂量来进行实验。β-actin和Histone H3 的蛋白质免疫印迹结果显示,染色质组分和可溶性胞质与核质组分成功分离(图5a和b)。XRCC1蛋白质免疫印迹结果显示随UV照射剂量的升高,XRCC1在染色质中的聚集逐渐累积(图5a和d),提示随UV照射剂量增加,造成更多DNA损伤,导致更多的修复蛋白结合到核基因组上。但在90J/m2的高剂量下XRCC1的富集却急剧降低,我们猜测可能是UV高剂量照射会快速引起细胞凋亡进而抑制DNA修复。随后我们也在U2OS细胞中得到了相似的结果。
第三章 实验结果........................... 13
3.1 p53通过蛋白质相互作用调控XRCC1的聚集 ...................... 13
3.1.1 p53蛋白与XRCC1存在蛋白质相互作用 ........................... 13
3.1.2 UV照射对p53与XRCC1蛋白质相互作用无影响 ................. 14
第四章 讨论与总结 ................ 27
4.1 讨论 ....................... 27
4.2 总结 .............................. 29
4.3 工作展望 ................. 30
第五章 文献综述..................... 31
5.1 DNA损伤修复机制研究进展 ............................. 31
5.1.1 DNA损伤类型 ................................... 31
5.1.2 DNA损伤修复途径 ................................. 32
第四章 讨论与总结
4.1 讨论 1、p53与XRCC1的相互作用的方式及相互作用结构域:
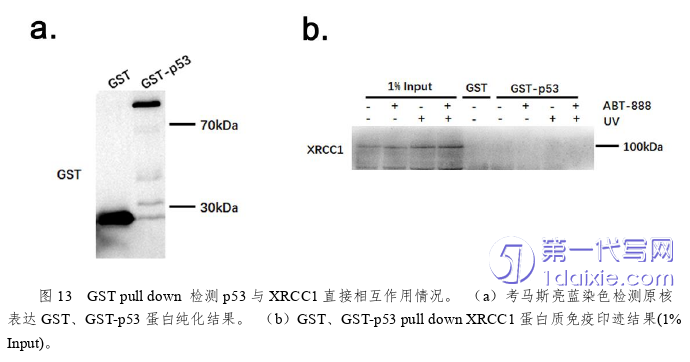
p53蛋白通常通过转录水平调控损伤修复基因的表达或与修复蛋白形成相互作用促进修复,如通过募集p300组蛋白乙酰化酶以增强染色质的松弛[17]。在本课题中,我们通过免疫共沉淀实验也证实了U2OS细胞内p53通过与XRCC1蛋白质相互作用来调控其在UV损伤位点的聚集。但两者相互作用为直接还是间接我们仍不清楚。我们通过GST-pull down实验用原核表达GST-p53蛋白来拉HCT116 p53-/-细胞内XRCC1蛋白,并未成功在沉淀物中检测出XRCC1蛋白(图13b)。但我们仍无法确定究竟是由于p53与XRCC1相互作用为间接方式,还是p53需要在真核系统中进行某种修饰才能与XRCC1相结合。另外,对于发生两者相互作用的具体位点,我们也尚未探究。前期课题组构建了XRCC1在1-311、311-537段的稳转细胞,但未发现p53与该两段存在相互作用,故我们猜测与p53相互作用的片段可能为538-633段上的BRCTII结构域,该段结构域已被证实能够与Lig3形成强复合物至损伤位点连接断裂缺口[18]。后续研究中我们将构建稳转表达FLAG-XRCC1(538-633)段的细胞,来探究XRCC1蛋白中与p53相互作用的结构域。
第五章 文献综述
5.1 DNA损伤修复机制研究进展
保持遗传物质DNA完整性和准确性对于细胞乃至整个生物体至关重要。但DNA不可避免地受到细胞内外因素的影响而产生各种DNA损伤,对此细胞进化出DNA损伤应答机制(DNA-damage response ,DDR),在DNA损伤后,细胞能够启动细胞周期停滞,修复各种类型DNA损伤,以维持生物体正常生理活动。
5.1.1 DNA损伤类型
DNA损伤因素可以大致分为两类:细胞内源性因素和外源性环境因素。内源性因素引起的DNA损伤主要包括复制差错、氧化性DNA损伤、DNA修饰等[19]。人类细胞每次DNA复制大约合成3×109个碱基对[20],DNA聚合酶的结构与生化性质决定了DNA合成的高保真性,可确保在模板碱基对面插入正确的互补脱氧核苷酸。DNA错配修复 (Mismatch repair, MMR) 途径能够纠正已逃脱复制聚合酶校对的罕见错误,将复制保真度提高 100 倍以上[21]。尽管如此,由于细胞环境中 dNTP的相对浓度等因素的变化,碱基替换、缺失和单碱基插入错误仍然以每细胞每代10 -6到10 -8的频率累积[20]。另外,大多数内源性因素引起的DNA损伤源于DNA与活性氧 (ROS) 发生的氧化反应[4]。在低水平下,ROS发挥着重要的细胞功能,例如在氧化还原信号反应中充当细胞信使,并通过免疫系统对入侵的病原体进行防御反应[22, 23]。过量的 ROS 则会导致DNA近百种不同的氧化碱基损伤和 2-脱氧核糖修饰[24, 25]。伴随着细胞各种生理活动的进行,自发性碱基脱氨基、甲基化等修饰也是细胞诱发损伤的主要来源。碱基脱氨基通常发生在腺嘌呤、鸟嘌呤、胞嘧啶及5' -甲基胞嘧啶中[4],并且往往在活跃的复制、转录和重组等过程中的DNA单链形式下[26]。无碱基位点是连接碱基与磷酸骨架的 N-糖基键自发水解或被 DNA 糖基化酶切割形成碱基切除修复中间体时产生[27]。在人体细胞中,每天会产生大约 104 个无碱基位点。但无碱基位点本质上是不稳定的,并且很容易从脱氧核糖 3' 磷酸二酯键的 β-消除反应中转化为单链断裂(SSB)[28]。
参考文献(略)
