本文是一篇医学论文,我们的研究为黑色素瘤等恶性肿瘤药物的开发提供了新的思路和理论基础,也为黑色素瘤的治疗提供了新的思路。
第2章 文献综述
2.1 细胞膜伪装的纳米平台
2.1.1 引言
基于纳米技术,尤其是纳米平台,治疗肿瘤在医学研究中渐渐成为一种常用的方法。与目前临床上的诊断和治疗方法相比,纳米平台疗法都更具有优势[12]。但是这种疗法也存在缺点。由于人体是高度复杂的环境,纳米平台在进入人体后必然会接触到血液中的细胞和蛋白质成分,这会影响其发挥性能。除此之外,网状内皮系统对纳米平台的清除也阻碍了其疗效的发挥[13, 14]。 考虑到合成纳米平台遇到的挑战,研究人员们最近致力于仿生纳米平台。作为生物学最基本的单位之一,细胞会与其他细胞、各种蛋白质和细胞外基质接触,能够在复杂的人体环境中执行特定的任务。因此,越来越多的研究人员对细胞进行仿生设计,希望发现令人难以置信的特异性和灵敏性[15]。
细胞膜涂层的纳米平台应运而生。由于具备细胞膜上特异性蛋白质,该平台具有疾病相关的特异性靶向和长效的血液循环[7, 16]。除此之外,细胞膜涂层技术简单易行,是采用一种自上而下的方法完成的。目前,已经有研究人员将红细胞膜、白细胞膜、血小板膜、干细胞膜、癌细胞膜和混合膜等各种细胞膜用于伪装纳米粒子[17, 18]。
2.1.2 红细胞膜伪装的纳米平台
红细胞是存在于自然界中能够长效循环的载体。这些细胞在人体中的寿命高达 120 天,这种特性使它们能够履行运输氧气的生物功能[19]。红细胞膜表面富含蛋白质、聚糖和受体,可以绕过免疫系统的攻击,使得红细胞膜成为仿生纳米平台细胞膜涂层有吸引力的首选[20]。例如,红细胞膜表面最具代表性的膜蛋白之一CD47, 是一种免疫调节蛋白,它作用于巨噬细胞的抑制性受体SIRPα , 以抑制巨噬细胞的摄取和吞噬作用[21]。胡等人第一次报道了红细胞涂层的纳米平台,该纳米平台具有免疫逃逸和长效血液循环的特性。由于红细胞收集的便利性和胞内细胞器的缺乏,令细胞膜的收集和纯化得以高效进行。因此,红细胞涂层的纳米平台得以快速扩展,成为仿生纳米平台领域研究最充分的系统[7]。
2.2 光动力疗法治疗癌症
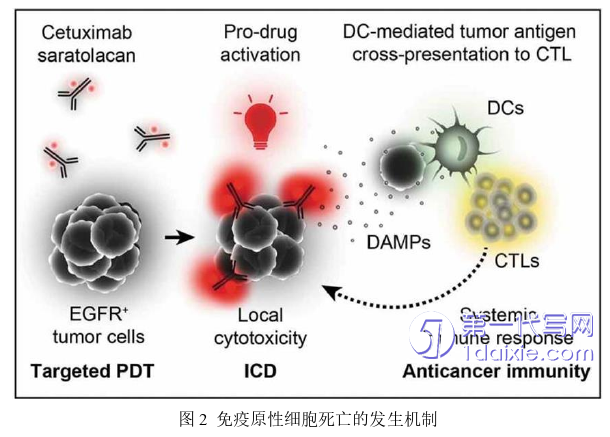
涉及癌症的光动力疗法(PDT)是用适当波长的光照射病变部位,使聚集在病灶组织的光敏药物活化。在组织和细胞中存在氧分子的情况下,活化的光敏药物会将光能传递给周围的氧分子,从而产生活性氧(ROS),这种活性氧会对细胞产生毒性,从而杀死癌细胞[35]。
1900年,奥斯卡·拉布在赫尔曼·冯·塔佩纳教授的指导下,于德国慕尼黑进行不同染料对原生动物生存力影响的实验。他发现了一个奇怪的现象:存在吖啶红染料的情况下,光照射滴虫会导致滴虫死亡。有趣的是,与存在吖啶红染料但是不给光或者不存在吖啶红染料但是给光相比,观察到的效果更明显。这一现象引发了赫尔曼·冯·塔佩纳教授和奥斯卡·拉布的深思,他们推测这种现象类似于光合作用,不同的是,这种现象将光能转移到了染料中去。随后,赫尔曼·冯·塔佩纳教授称此现象为光动力效应,并首次提出了将光动力效应应用于医学的可能性[36]。
然而40多年后,研究人员才对光动力效应进行一系列实验。1948年,菲格发表文献提出,对小鼠注射外源性卟啉可以使其选择性地积聚在肿瘤部位[37]。
1955 年,施瓦茨发现了第一代光敏剂卟啉衍生物。 1980 年代以来,光动力疗法得到了飞速的发展,正在开发不同化学性质的光敏剂,并且光动力疗法也被应用于癌症治疗中去[38]。
第3章 仿生纳米囊泡的构建、表征以及对恶性黑色素细胞的治疗
3.1 引言
恶性黑色素瘤是一种侵袭性强的恶性肿瘤,临床上常见的手术疗法晚期预后较差。光动力疗法 (PDT)可以产生活性氧(ROS) 从而有效抑制肿瘤生长。但是PDT疗法也存在缺点,光敏剂的体内快速清除、光降解以及低靶向性令其无法广泛应用于临床。随着纳米医学的发展,研究人员将光敏剂ICG加载到不同的纳米材料中以克服这些缺点。然而,由于纳米材料生物相容性差,其经常被机体免疫系统识别,导致快速清除和毒性免疫反应。
癌细胞膜衍生的囊泡,因其自然表面特性,不会受到机体免疫系统的攻击,从而维持长效的血液循环。除此之外,癌细胞膜衍生的囊泡具备特殊的蛋白质,例如肿瘤相关抗原,使其可以主动靶向到肿瘤部位,实现精准治疗。
本章的主要内容为将吲哚菁绿(ICG)装载到恶性黑色素瘤B16细胞膜中形成纳米囊泡(后文简称I@BM NVs)。肿瘤细胞膜的同源靶向可以增强ICG药物的PDT作用。我们对合成的纳米囊泡进行了表征,并且使用了不同的浓度进行一系列体外细胞实验,验证合成的纳米囊泡的疗效。
3.2 实验材料和方法
3.2.1 实验仪器
本实验使用小鼠恶性黑色素瘤B16细胞系进行后续培养。首先打开超净工作台的紫外线灯,对超净工作台内部进行消毒灭菌,照射时间为30分钟。之后关闭紫外线灯,打开超净工作台,按下通风键位通风2分钟。然后打开酒精灯,准备复苏细胞,此时需要提前准备好复苏细胞所需的实验试剂以及仪器。具体如下:培养细胞所需的完全培养基,该完全培养基由DMEM高糖培养基、1%青霉素-链霉素、10%胎牛血清配置而成;10厘米直径的无菌细胞培养皿若干;15ml离心管;1ml量程的微量移液器;无菌枪头。
第3章 仿生纳米囊泡的构建、表征以及对恶性黑色素瘤细胞的治疗 .......................................... 13
3.1 引言 ........................................... 13
3.2 实验材料和方法 .................................... 13
第4章 仿生纳米囊泡在体内对恶性黑色素瘤的治疗 ...................... 29
4.1 引言 .......................................... 29
4.2 实验材料和方法 ..................................... 29
第5章 讨论 ................................ 37
第5章 讨论
本研究的主要亮点是纳米囊泡的合成简单,多次挤压后囊泡尺寸和形状均一。除了在 808 nm 近红外光照射下产生活性氧(ROS)外,I@BM NVs还激活了免疫系统,促进肿瘤微环境由免疫抑制向免疫促进转化。因此,合成的纳米囊泡表现出优异的光动力效应和抗癌免疫反应。除此之外,I@BM NVs 对同源细胞也有很高的亲和力,这与之前的一些报道一致[9, 59]。而且,由于同源靶向效应,它们的光动力效果更优越。裸鼠体内实验结果显示,注射后24小时,I@BM NVs在肿瘤部位明显聚集,而ICG单体主要聚集在肝脏和肾脏,没有明显的肿瘤靶向作用。与 ICG 单体类似,I@BM NVs 主要由肝脏和肾脏代谢。 H&E 结果表明,I@BM NVs不会对小鼠的肝脏或肾脏造成损害。令人欣喜的是,与其他分组相比,I@BM NVs对B16荷瘤小鼠的肿瘤生长具有最大的抑制作用,可以显着延长荷瘤小鼠的存活期。根据文献,添加疫苗佐剂或使用包括免疫检查点抑制剂药物(如 PD-1)的组合可以增强纳米药物的抗肿瘤作用[60-62]。我们将在未来的工作中使用这些策略来进一步提高抗肿瘤NV的影响。
肿瘤微环境是肿瘤治疗的重要因素。它与肿瘤本身形成一个完整的生态系统,促进肿瘤生长和转移,同时影响免疫。克服肿瘤微环境的免疫抑制作用可以改善临床结果。通过分析荷瘤小鼠肿瘤微环境中的免疫细胞,我们发现 I@BM NVs 组中抑制肿瘤和增殖的 Ki67+CD8+ 和 Ki67+CD4+ T 细胞数量显着增加,表明活跃的增殖性 T 细胞数量增加。I@BM NPs 诱导的免疫治疗将在注射后对抗肿瘤。此外,抑制性免疫细胞的比例显着降低,包括 TAM-M2、MDSCs 和 Tregs;这些抑制性免疫细胞有利于肿瘤的生长。细胞因子的 qRT-PCR 结果显示 IL-2 和 IFN-γ 水平显着增加,而 IL-10 和 TGF-β 的表达降低。这些结果表明,I@BM NVs可以提高具有增殖活性的T细胞比例,降低促进肿瘤生长的抑制细胞比例,对肿瘤微环境具有整体积极作用。
第6章 结论
一般来说,I@BM NVs 与 PDT 和免疫疗法相结合来治疗黑色素瘤,在 808 nm 激光照射下会导致肿瘤细胞凋亡。此外,作为释放的肿瘤相关抗原的凋亡肿瘤细胞与B16细胞膜一起作为肿瘤抗原引发抗肿瘤免疫反应。免疫疗法有效地将免疫抑制的肿瘤微环境转变为免疫增强的肿瘤微环境。该方法具有显着优势,包括但不限于成本低、合成方法简单、NVs形态均匀、性质稳定,以及能够有效抑制体内黑色素瘤的肿瘤生长。 我们的研究为黑色素瘤等恶性肿瘤药物的开发提供了新的思路和理论基础,也为黑色素瘤的治疗提供了新的思路。
参考文献(略)
