第一部分
骨髓源性间充质千细胞的分离、培养、鉴定和分化
前言
间充质干细胞(mesenchymal stem cells )是最早从骨髓中分离出的非造血类间质细胞。随后在成体其它结缔组织中也发现了间充质肝细胞。可以增殖、分化为多种结缔组织细胞,如神经细胞16]、骨细胞软骨细胞、月旨肪细胞肌细胞和骨髓基质细胞等[24_26]。间充质干细胞在组织发生损伤、炎症或坏死时,通过分子信号,诱导间充质干细胞活化修复组织[27]。静脉注射MSC会发现MSC迁移到损伤部位在心肌梗死骨折大脑缺血[31_32]、脊椎损伤[33]等情况下,这一修复功能均得到了证明[29]。有研究发现,将MSCs皮下注射到损伤的膝关节附近,可以使损伤的软骨和半月板再生[34]。
分离MSC的方法主要有三种:(1)全骨髓贴壁培养法,由于骨髓腔内还有少量的细胞外基质,抽取的骨髓很容易通过机械方法如吹打等方法破碎基质,将细胞打均匀。细胞接种于培养皿后,BMSC可以快速的點附在培养皿上,通过反复换液将不具备黏附能力的造血干细胞去除。(2)密度梯度离心法,将骨髓样品抗凝处理后,转入装有密度为1.073的密度梯度溶液的离心管中,室温下离心,大部分红细胞沉淀下来,有核细胞在分界面和上层液体中,吸取有核细胞培养。(3)根据MSC表面标志,利用流式细胞仪进行分选。
由于骨髓腔内含有少量的细胞外基质,抽取的骨髓很容易通过机械的方法,利用吹打的方式将造血类细胞和间充质干细胞分离为单细胞状态,当低密度接种后,BMSC可以迅速點附在细胞培养皿上,通过反复换液就可将造血干细胞去除。我们利用Percoll密度梯度离心法首先分离出骨髓中的单个核细胞(mononucleated cells),再将其接种到培养皿上进行贴壁蹄选、扩增。通过加入血管内皮生长因子VEGF诱导MSC向内皮细胞分化,为MSC在血管内皮修复及血管新生中的应用奠定细胞学基础。
材料与方法
1试验用动物
健康C57BL/5J小鼠40只,体重2()±5g,雌雄各半。购买并饲养与复旦大学上海医学院动物实验室,环境为SPF级别,自由摄取词料和水,动物使用符合上海市动物管理委员会条例。
2主要试剂
DMEM低糖培养基 GIBCO公司
DMEM高糖培养基 GIBCO公司
胎牛血清(Febal bovine serum,FBS) GIBCO 公司
M199培养基 GIBCO公司
血管内皮生长因子(VEGF) Peprotech公司
兔抗小鼠VWF单克隆抗体 Abeam公司
兔抗小鼠CD34单克隆抗体 Abeam公司
FITC标记兔抗小鼠CD29单克隆抗体 Abeam公司
FITC标记兔抗小鼠CD105单克隆抗体 Abeam公司
PE标记兔抗小鼠CD45单克隆抗体 Abeam公司
PE标记兔抗小鼠CD90单克隆抗体 Abeam公司
PE标记兔抗小鼠KDR单克隆抗体 Abeam公司
4’,6-二脒基-2-苯基n引噪(DAPI) Sigma公司
噻哩蓝(MTT) Sigma公司
淋巴细胞分离液(Percoll) Sigma公司
Matrigel基质胶 BD公司
憐酸盐缓冲液(PBS) Gibco公司
二甲基亚柄(DMSO) Sigma公司
Dil标记乙醜低密度脂蛋白(Dil-acLDL) Sigma公司
FITC标记的荆豆凝集素1 (FITC-UEA-1) Sigma公司
胰酶-乙二胺四乙酸 Sigma公司
青霉素-链霉素 Sigma公司
10%山羊血清 Boster公司
二氨基联苯胺(DAB)显色剂 Boster公司
地塞米松、n引哚美辛、油红、1-甲基-3-异丁基-黄噪呤、胰岛素、均为国产分析纯
3主要仪器设备
超净工作台 苏州净化设备有限公司
二氧化碳培养箱 Heraeus公司
倒置相差显微镜 OLYMPUS公司
倒置突光显微镜 OLYMPUS公司
正置焚光显微镜 OLYMPUS公司
激光共聚焦显微镜 Leica公司
电子分析天平 上海精密科学仪器有限公司
高速台式离心机 上海安亭科学仪器厂
电热恒温水浴箱 上海跃进医疗器械一厂
Midi Plus电动移液器 上海大龙医疗设备有限公司
移液枪酶标仪 BIO-RAD公司
流式细胞仪 BD公司
低温冰箱 (-20°C、-80°C) 日本三洋公司
细胞培养皿(直径35mm、60mm和100mm)、离心管(15ml和50ml)、移液管(1ml、10ml、25ml)、细胞冻存管、96、24、6孔细胞培养板 Coming公司
4主要溶液的配制
1 Ml99培养液
溶液组分 含量
Ml99培养基
胎牛血清 10%
青霉素-链霉素 100单位/ml
血管内皮生长因子 5ng/ml
依次在M199培养基中加入上述成分,每瓶500ml分装,4°C保存备用2 DMEM培养液
溶液组分 含量
DMEM低糖培养液胎牛血清 10%
青霉素-链霉素 100单位/ml
依次在DMEM培养基中加入上述成分,每瓶500ml分装,4°C保存备用3月旨肪诱导培养液
溶液组分 含量
DMEM低糖培养液
胎牛血清 10%
双抗 100单位/ml
地塞米松 l[nnol/L
吲哚美辛 lOO^imol/L
胰岛素 lOmg/L
1-甲基-3-异丁基-黄噪呤 0.5mmol/L
依次在DMEM培养基中加入上述成分,每瓶500ml分装,4°C保存备用3MTT 溶液(5mg/ml):
取MTT lOOmg,溶于20ml的PBS中,0.22pm的一次性滤器过滤除菌,分装后,-20°C避光保存备用。
4细胞冻存液
DMSO: FBS:培养液=1: 1: 8,加入DMSO,FBS到培养液,分装,4°C保存备用。
5试验方法
1小鼠骨髓间充质干细胞的分离、培养
1) .20g健康C57BL/6J小鼠,颈椎脱臼法处死小鼠,完全浸没于75%的乙醇中5min,超净工作台上解剖小鼠的股骨和腔骨,注射器抽取DMEM低糖培养液(含肝素lOu/ml),冲洗骨髓腔3-4次,冲出骨髓细胞,轻轻吹打,制成单细胞悬液。
2)将上述细胞悬液按1: 1的比例,缓缓加入预先置有密度为1.073的Percoll细胞分离液的试管中,室温水平离心2000rpm/min,离心20分钟。
3)离心后,可见管内分为四层,上层为血楽、细胞培养液和血小板,中层为淋巴细胞分离液,下层主要是红细胞和多核白细胞,在上层和中层之间为一层云雾状单个核细胞层。
4)吸取云雾状单个核细胞层,加入DMEM低糖培养基,1500rpm离心3min。
5)洗洛两遍。用DMEM低糖培养基(10%FBS)重悬细胞,混匀后计数,以lxl04/ml接种于细胞培养皿中,置于37°C、5%C02细胞培养箱中培养。
6)接种48h后,PBS轻轻冲洗,洗去未贴壁的细胞,更换新鲜的培养液。
7)以后每三天换液一次,同时倒置显微镜下观察细胞生长情况和细胞形态。等到一周左右,细胞长到80%融合时,0.25胰酶-EDTA消化,按1: 4的比例进行细胞传代。
2骨髓间充质干细胞流式鉴定
1)取传代扩增后的上述P2代细胞,0.25%胰酶-EDTA消化3分钟,DMEM-LG(10%FBS)终止消化,1500rpm离心3分钟,PBS溶液清洗,1500rmp再次离心三分钟,PBS溶液调整细胞浓度至l><106/ml。将细胞悬液分装至Eppendorf管。
2)分别加入抗CD29、CD34、CD45、CD90和CD105的单克隆抗体,阴性对照不加一抗。室温孵育30inin。PBS洗漆三次,lOOOrpm离心5分钟,弃上清。
3)加入相应的FrrC、PE标记的二抗,4 °C避光孵育半小时。PBS洗涂细胞2次除去未结合的抗体,4%多聚甲醛固定30分钟,上机检测。
3 MTT法制备骨髓间充质干细胞生长曲线
1)取鉴定后的P2代细胞,0.25%的胰酶胰酶-EDTA消化成单细胞悬液,调整浓度为IxloVml,以每孔lOO^il体积将细胞接种到96孔板,每三孔为一组。分别在接种后的1、2、3、4、5、6、7、8、9天MTT法检测细胞活力
2)检测时,每孔加入MTT (5mg/ml)溶液15^il, 37°C继续孵育4小时后,弃孔内上清培养液,每孔加入15(HilDMS0,轻轻振荡10分钟,使结晶物充分溶解。
3)在酶联免疫检测仪上检测各孔的光吸收值,波长设定为490nm,记录结果,以天数为横轴,光吸收值为纵轴绘制细胞生长曲线。
4骨髓间充质干细胞向脂肪细胞的诱导分化
取体外扩增培养的P3代MSC,0.25%的胰酶-EDTA消化,制成细胞悬液,调成细胞浓度至l><105/ml,将细胞接种到24孔板中,当细胞贴壁生长达到70%融合时,加入脂肪诱导培养基,37°C、5%C02培养箱继续培养。每三天换一次诱导培养基,倒置显微镜观察细胞形态和生长状况。
5诱导后脂肪细胞的鉴定
1)取诱导后的培养细胞,PBS清洗两遍,洗去未贴壁的细胞。加入甲醇,固定10分钟。然后70%乙醇漂洗两次。
2)加入2%的油红0染料染色,室温放置5分钟,然后弃去染料,70%乙醇漂洗两次,用水冲洗。
3)加入苏木精复染1分钟,倒置相差显微镜下观察脂肪细胞形态及染色情况。
6骨髓间充质干细胞向内皮细胞的诱导分化
取体外扩增培养的P3代MSC,0.25%的族酶-EDTA消化,制成细胞悬液,调成细胞浓度至l><105/ml,将细胞接种到细胞培养瓶中,当细胞贴壁生长达到70%融合时,加入 M199 培养基(10。/。FBS、5ng/ml VEQF), 37°C、5%C02 培养箱继续培养。每三天换一次诱导培养基,倒置显微镜观察细胞形态和生长状况。
7 MTT法制备内皮细胞生长曲线
1)取诱导后的Pi代细胞,0.25%的胰酶-EDTA消化成单细胞悬液,调整浓度为lxl05/ml,以每孔lOOpl体积将细胞接种到96孔板,每三孔为一组。分别在接种后的1、2、3、4、5、6、7、8、9天MTT法检测细胞活力
2)检测时,每孔加入MTT (5mg/ml)溶液15^il,37°C继续孵育4小时后,弃孔内上清培养液,每孔加入150^ilDMSO,轻轻振荡10分钟,使结晶物充分溶解。
3)在酶联免疫检测仪上检测各孔的光吸收值,波长设定为490mn,记录结果,以天数为横轴,光吸收值为纵轴绘制细胞生长曲线。
7诱导后内皮细胞的鉴定
7.1免疫组化鉴定内皮细胞
1)取诱导扩增后的Pi代内皮细胞,0.25%的胰酶-EDTA消化,制成细胞悬液,调成细胞浓度至IxloVml,将细胞接种到玻片上,过夜培养。第二天PBS清洗玻片,4%多聚甲酵固定。
2) PBS清洗三遍,10%山羊血清封闭30min
3)加入1: 100兔抗小鼠VWF,37°C孵育1小时。
4)PBS清洗三遍,加入1: 100的羊抗兔二抗,37°C孵育1小时。PBS清洗,力口入 DAB (1: 50)染色。
5)光镜下观察细胞染色情况,并对阳性细胞进行计数。
7.2免疫突光鉴定内皮细胞
7.2.1 CD34、VEGF抗体鉴定内皮细胞
1)取诱导扩增后的Pi代内皮细胞,0.25%的胰酶-EDTA消化,制成细胞悬液,调成细胞浓度至l><105/ml,将细胞接种到玻片上,过夜培养。第二天PBS清洗玻片,4%多聚甲酵固定。
2)PBS清洗三遍,10%山羊血清封闭30min
3)分别加入1 : 100 FITC标记兔抗小鼠CD34 —抗、PE标记的兔抗小鼠VEGF一抗,37°C孵育1小时,PBS清洗,加入DAPI, 37°C孵育5分钟。
4)PBS清洗三遍,突光显微镜下观察细胞染色情况,并对阳性细胞进行计数。
7.2.2 LDL-UEA-1鉴定内皮细胞
1)取诱导扩增后的Pi代内皮细胞,0.25%的胰酶-EDTA消化,制成细胞悬液,调成细胞浓度至IxloVml,将细胞接种到玻片上,
2)将Dil-acLDL加入细胞培养体系,终浓度为2.5pg/ml, 37°C、5%C02培养箱中孵育2h,PBS洗漆2-3次,4%多聚甲酸固定15分钟,加入FITC-UEA-l,终浓度为10^ig/ml,室温下放置1小时后,PBS清洗2-3次。
3)焚光显微镜下观察,吞噻Dil-acLDL后,细胞呈现红色焚光,与FITC-UEA-1结合后,细胞呈现绿色突光。任选5个视野进行细胞计数,阳性率=阳性细胞数/细胞总数
7.3内皮细胞成管功能试验
1)将枪头、6孔细胞培养板置于冰盒上,使其处于低温状态,取Matrigel基质胶加入到6孔板内,每孔200^U。37°C、5%C02培养箱静置,至胶凝固。
2)取诱导扩增后的Pi代内皮细胞,0.25%的胰酶-EDTA消化,制成细胞悬液,调成细胞浓度至lxl05/ml,将细胞接种到Matrigel胶上。
3) 37°C、5%C02培养箱培养,每三天换次M199诱导培养基。分别于第1、3、7天,倒置显微镜下观察细胞成管形态。
4)显微镜拍照观察细胞变化
8统计学处理
试验结果均以平均数±标准差(±SD)表示。
结果
1小鼠骨髓MSC的基本形态
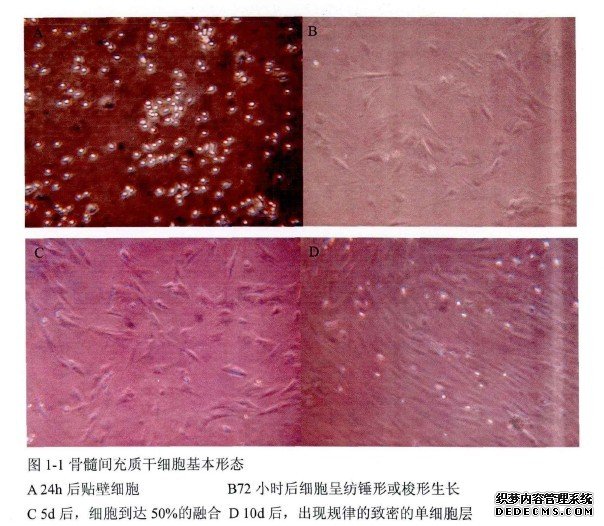
用Percoll细胞分离液梯度离心从骨髓中分出单个核细胞,接种于DMEM-LG培养液中,接种初始,细胞呈悬浮生长,小圆形细胞形态,细胞接种12h后,可见有圆形或摘圆形细胞贴壁(图l-1-a), 72h后出现散在的纺锤状贴壁细胞,MSC贴壁稀疏时,长梭形细胞的两极朝向并不规律,细胞排列混乱(图l-1-b)。细胞培养5天后,细胞明显增多,细胞融合在50%左右(图1-1-C)。细胞培养10天后,出现致密的贴壁细胞层,此时细胞的两极开始有规律地排列成束状(图l-1-d),也有呈漩祸状。
2骨髓间充质干细胞流式鉴定
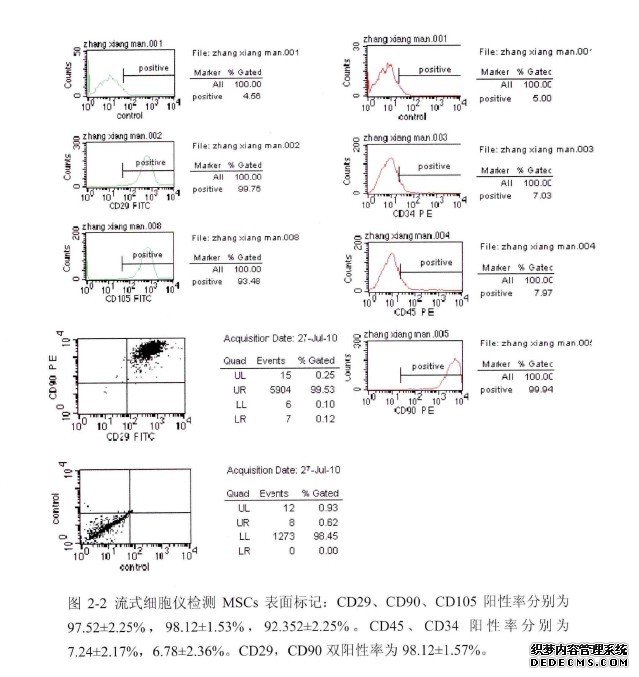
取培养扩增后的P2代骨髓间充质干细胞进行流式细胞仪检测MSCs表面标忐 CD29、CD34、CD45、CD90、CD105。结果显示,CD29、CD90、CD 105阳性率分别为 97.52±2.25%,98.12士1.53%,92.352±2.25%。CD45、CD34 阳性率分别为 7.24士2.17%,6.78±2_36%。CD29,CD90 双阳性率为 98.12±1.57%。(见图 2-2)
3骨髓间充质干细胞生长曲线
细胞生长曲线是测定细胞绝对生长数的常用方法,也是判足细胞活力的重要指标。我们通过MTT法检测了骨髓间充质干细胞Pi代1-9内细胞生长数口。根据测定数值,绘制的生长曲线呈“S”形(如图1-3),可分为潜伏期,对数生长期和平台期。细胞接种后1-3天内,细胞生长相对缓慢,细胞增殖并不活跃。4-6天细胞进入对数生长期,细胞快速生长,增殖活跃。7天以后,细胞进入平台期,生长稳定,致密的贴壁细胞层开始形成。
第二部分:可降解Poly(EC-CL)电纺................................... 30-41
前.......................................................... 30
材料与...................................... 30-33
结...................................... 33-38
讨........................................... 38-40
结.................................. 40-41
第三部分:Poly(EC-CL)/VEGF电纺支架的制备及生..................................... 41-60
前............................................................ 41
材料与.................................................. 41-48
结................................................ 48-57
讨................................... 57-59
结.......................................... 59-60
第四部分:仿生肝脏血管网络的........................ 60-74
总结
组织工程化组织的构建是以修复组织、器官缺损为最终目的的,组织工程化器官的临床应用将进一步改变现行的医学模式,将再生医学应用于疾病的治疗,为医学的发展带来翻天覆地的变化。
参考文献
[1] Fiegel HC, Kaufmann PM,Bruns H, et al. Hepatic Tissue Engineering, fromtransplantation to customized cell-based liver directed therapies from the laboratory. J CellMolMed. 2008, 12(1): 56-66
[2]_Au P,Tam J, Fukumura D, et al. Small blood vessel engineering. Methods Mol Med.2007, 140:183-195.
[3] Weibberg CB, Bell E. A blood model constructed form collagen and cultured vascularcells. Science. 1986; 231: 397-400
[4]刘文辉,刘晓亚,壳聚糖基生物医用材料及其应用研究进展。功能髙分子学报,2001,14 (4): 493
[5] Singh DK, Ray AR. Biomedical applications of chitin chitosan and their derivatives [J]. J.Macromol. Sci. Rev. MacromoL Chem. Phys., 2000. 40 (1): 69-83.
[6] Gupta KC, Ravikumar MN. Overview on chitin and chitosan applications with an emphasison controlled drug release formulations [J]. J. MacromoL Sci. Rev. Macromol. Chem. Phys.,2000. 40 (4); 273-308.
[7]Sudesh K,Abe H, Doi Y Synthesis, http://www.1daixie.com/dxjsjlw/ structure and properties of polyhydroxyalkanoates:Biological polyesters [J]. Prog. Polym. Sci.,2000. 25(10): 1503-1555.
[8] Khor E,Lim LY Implantable applications of chitin and chitosan [J]. Biomaterials,2003,24(13): 2339-2349.
[9] Grassl ED, Tranquillo RT, et al. Fibrin as an alternative biopolymer to type-I collagenfor the fabrication of a media equivalent. J Biomed Mater Res. 2002; 60:607-612
[10] Shirota T,He HB,Yashu H, Matsuda T. Human endothelial progenitor cell-seededhybrid graft: Proliferative and antithrombogenic potentials in vitro and fabricationprocessing. Tissue Eng, 2003; 9: 127-136
